Química
Estequiometría
|
| INSTITUTO POLITÉCNICO NACIONAL | |
| UNIDAD PROFESIONAL INTERDISCIPLINARIA DE INGENIERÍA Y CIENCIAS SOCIALES Y ADMINISTRATIVAS | ||
LABORATORIO APLICACIÓN DE PROCESOS
QUÍMICOS INDUSTRIALES
PRACTICA No. 8
estequiometría
SECUENCIA: 3NMC
-
CONSIDERACIONES TEÓRICAS
OBJETIVO:
-
Calcular el costo de producción de una reacción química con base en costo de las materias primas
-
Efectuar cálculos estequiometricos para determinar el rendimiento de una reacción química a partir de datos experimentales.
INTRODUCCIÓN
La estequiometría es la parte de la química que se refiere a la determinación de las masas de combinación de las substancias en una reacción química.
Esta cuantificación tiene como base la ley de la conservación de la masa establecida por Lavoisier que establece lo siguiente
“La suma de las masas de los reactivos es igual a la suma de las masas de los productos”
Para efectuar cálculos estequiometricos es necesario representar la reacción química por medio de una ecuación balanceada de la que a su vez es posible obtener información relacionada con el tipo de sustancias que participan en el proceso, propiedades físicas de las mismas, dirección o sentido de la reacción, absorción o desprendimiento de energía calorífica, etc.
Ejemplo:
![]()
![]()
De esta ecuación que representa la producción de amoniaco a partir de hidrogeno y nitrógeno, se puede decir que se trata de una reacción de síntesis, reversible, exotérmica, homogénea, cabalizada y en la que 6 unidades de masa de hidrogeno se combinan con veintiocho unidades de nitrógeno, para producir treinta y cuatro unidades de masa de amoniaco. El amoniaco se emplea para producir fertilizantes.
Estas unidades de masa pueden ser en gramos, kilogramos, toneladas, etc.
Si la unida de masa se refiere específicamente al PESO MOLECULAR GRAMO, entonces se expresará en gramos, por que el peso molecular es la suma de los pesos atómicos de los átomos representados en la formula de la sustancia.
En el caso anterior, el peso molecular de amoniaco es 17 y se encuentra representado dos veces según el balance de la ecuación.
Pesos atómicos ![]()
Peso molecular ![]()
En un proceso industrial en el que ocurre una ecuación química es necesario hacer uso de la estequiometria con el fin de establecer un balance de materias, mismo que conlleva un balance económico al considerar el costo de las materias primas en las cantidades requeridas para una producción preestablecida
La estequiometría permite resolver problemas inherentes al calculo de las cantidades de reactivos para obtener un producto o bien al calculo estequiometrico son
-
PUREZA DE UN REACTIVO
-
RENDIMIENTO DE UNA REACCIÓN
La pureza de un reactivo: es la relación en la que se encuentra una sustancia en especie dentro de una muestra.
![]()
El rendimiento de una reacción química indica en que medida, un reactivo se convierte en producto o bien en que cantidad se obtiene un producto con respecto a una cantidad teórica o ideal esperada.
![]()
Finalmente, con objeto de asegurarse que se consuma totalmente un reactivo se agrega otro en mayor proporción estequiometrica. Al principio se llama REACTIVO LIMITANTE y al segundo se la llama REACTIVO EN EXCESO.
Ejemplo. Sea el proceso
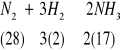
Se pregunta ¿Qué cantidad de amoniaco se podrá obtener a partir de 100![]()
de hidrogeno cuya pureza es del 99%, y nitrógeno en exceso, si la eficiencia de la reacción es del 80% ?
Solución. Los pesos moleculares representan las proporciones definidas en las que se combinan la sustancias, por lo que para cualquier otra cantidad de reactivo, habrá una cantidad proporcional de producto
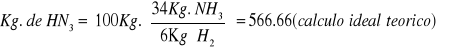
El resultado “real” se obtiene cuando se consideran los factores de pureza y rendimiento.
![]()
Como se ve la cantidad real de producto disminuye con respecto al cálculo ideal por los factores antes mencionados
-
material empleado
-
vaso de precipitados de 100

. -
vaso de precipitados de 250

-
soporte universal con anillo y tela de asbesto
-
embudo tallo largo para filtración simple
-
mechero Bunsen
-
agitador de vidrio
-
pinzas para crisol
-
vidrio de reloj
-
espátula chica
-
hoja de papel filtro de 10*10 cm.
-
estufa con termómetro
-
desecador
-
balanza electrónica
-
sustancias empleadas
-
Limadura de hierro (Fe) de 98.5% de pureza
-
Sulfato cuprico hidratado

(cristales) -
Agua destilada
-
Procedimiento
Lave el vaso de precipitados y enjuaguuelo con agua destilada. No es necesario secarlo pero manéjelo todo el tiempo con las pinzas para crisol.
Agregue 50 ![]()
de agua destilada al vaso y monte el equipo.
Pese el papel filtro y anote ese valor
Pese en el vidrio de reloj, limpio y seco, cinco gramos de sulfato cuprico penta hidratado y agréguelo al vaso con agua. Anote también el peso del vidrio de reloj limpio y seco
Agite con la varilla hasta disolución total luego caliente suavemente con flama baja para evitar que la solución comience a hervir. En ese momento, encienda la estufa para que alcance una temperatura comprendida entre 90 y 95 ![]()
.
Al mismo tiempo, pese en el vidrio de reloj, lo mas exacto posible un gramo de limadura de hierro.
Adicione poco a poco la limadura al vaso y continué el calentamiento con flama baja.
cuando todo el hierro haya reaccionado suspenda el calentamiento y deje enfriar el vaso con su contenido Nota: el término de la reacción se percibe porque en el fondo del vaso debe haber un residuo en forma de polvo fino color rojo y en algunas ocasiones porque la solución pierde su color azul.
Proceda a filtrar, agitando constantemente la solución para evitar que parte del producto se quede en el vaso. Si esto sucede agregue un poco de agua destilada. Reciba el filtrado en un vaso de 100 ![]()
Lave el residuo obtenido y luego coloque el papel que contiene el polvo rojo extendido sobre el vidrio de reloj para su secado en la estufa.
Observe constantemente su producto para verificar que se haya secado completamente lo cual ocurre entre 10 y 20 minutos.
Una vez que esté seco. Llévelo al desecador para que se enfrié durante cinco minutos y luego péselo nuevamente. Anote este valor.
Determine la masa de producto obtenido experimentalmente.
Masa de producto = (masa final de vidrio + papel + residuo) - (masa de vidrio + papel)
CONCLUSIÓN
La estequiometría nos sirve para calcular y conocer la cantidad de materia de los productos que se forma a partir de los reactivos.
En el caso de esta práctica, partimos que los reactivos son 5 gr. de CuSO4 y 1 gr. De Fe2 98.5 % de pureza. Durante la práctica, el reactivo limitante es el Fe2 ya que, durante la reacción química es el que se agota primero. Al hacer cálculos estequiométricos indicados en la pregunta 4 del cuestionario, obtenemos la cantidad de cobre esperada; esto porque debemos partir de la ley “la materia no se crea ni se destruye, solo se transforma” en otras palabras, todo lo que entra debe salir. Es por eso que la ecuación química debe estar balanceada. Esta reacción es de sustitución simple y es endotérmica, ya que para efectuarse requerimos de energía calorífica. También se calcula la eficacia de nuestro experimento.CUESTIONARIO
Complete la ecuación de la reacción química de simple sustitución, llevada a cabo en esta practica, con formular y nombres de las sustancias (reactivos y productos)
2CuSO4 (ac) + Fe2 (s) 2FeSO4 + Cu2
Donde:
CuSO4 Sulfato cúprico
Fe2 Limadura de Hierro
FeSO4 Sulfato ferroso
Cu2 Cobre
Clasifique este proceso de acuerdo con su dirección con el estado físico de las sustancias y de acuerdo con la energía calorífica requerida para llevarlo a cabo.
Es endotérmico ya que para que se lleve acabo la reacción química necesito de energía calorífica, es irreversible porque la flecha indica una sola dirección y es de sustitución simple.
¿Qué sustancia es el polvo rojo que se obtiene como producto principal en esta reacción y que aplicaciones industriales tiene?
Se obtiene cobre. La industria de transformación de los alimentos utiliza una cantidad importante de aleaciones de cobre y esto se debe a su elevada conductividad térmica, buena resistencia a la corrosión y fácil manejo. En la industria de los alimentos, el cobre es usado en pailas para la producción de mermelada y refinación de azúcar. Recipientes similares son usados en la fabricación de dulces y pastillas para propósitos médicos. El cobre también es utilizado en el manejo de alimentos líquidos. En la fabricación de cerveza, la fermentación se produce en calderas de cobre y el proceso de purificación del mismo se lleva a cabo en un equipo de destilación de cobre.
En la industria química muchos recipientes de reacción y filtros son de cobre o aleaciones así como en diversos tipos de cambiadores de calor, esenciales en los procesos químicos, Tanques metálicos fabricados a base de cobre son usados para el almacenamiento de ácidos y otros productos químicos. En una refinería de petróleo, las columnas de destilación y torres para producir cloro etano (un solvente de grasas) son fabricadas con una aleación de bronce al silicio.
Calcule la masa de cobre que teóricamente se esperaba obtener, con base en el reactivo limitante que es 1 gramo de hierro de 98.5% de pureza.
Datos.
5 gr. de CuSO4
1 gr. De Fe2 98.5 % de pureza
2CuSO4 + Fe2 2FeSO4 + Cu2
nFe2 = m / P. m. = 1 g/111.68 g/mol = 0.008954154 mol.
1 mol de Fe2 1 mol de Cu2
0.008954154 mol. de Fe2 0.008954154 mol de Cu2
m Cu2 = n * P. m. = 0.008954154 mol * 127.08 g/mol = 1.13789389 gr. de Cu2 (ideal)
m Cu2 = 1.13789389 gr. de Cu2 (ideal) * (0.985) = 1.120825482 gr. de Cu2 (real)
¿Existe diferencia entre el peso esperado teóricamente y el obtenido experimentalmente? Explique en cualquier caso.
El peso obtenido experimentalmente de Cu2 fue de 0.9 gr y el teórico es de 1.120825482 gr . Esto es porque durante el procedimiento del experimento pudo haberse medido mal o pudimos haber perdido materia en cada uno de los aparatos utilizados.
Determine el rendimiento de la reacción.
![]()
![]()
¿Qué cantidad de cobre podría obtenerse a partir de 100 g de hierro con una pureza de 99%, considerando además el rendimiento obtenido en el punto anterior?
Datos.
5 gr. de CuSO4
100 gr. De Fe2 99% de pureza
80.29% de rendimiento
2CuSO4 + Fe2 2FeSO4 + Cu2
nFe2 = m / P. m. = 100 g/111.68 g/mol = 0.895 mol.
1 mol de Fe2 1 mol de Cu2
0.895 mol. de Fe2 0.895 mol de Cu2
m Cu2 = n * P. m. = 0.895 mol * 127.08 g/mol = 113.7366 gr. de Cu2 (ideal)
m Cu2 = 113.7366 gr. de Cu2 (ideal) * (0.99) * (.8029) = 90.4059 gr. de Cu2 (real)
Investigue el costo de cada reactivo empleado en esta práctica y calcule el costo total de su experimento considerando únicamente las materias primas (agua, sulfato de cobre y hierro).
Nota: deberá hacer una cotización, por lo menos, con dos proveedores diferentes.
¿Qué le representa a usted, como administrador industrial, el costo de una materia prima y el rendimiento de una reacción química?
Como ingeniero en informática, representa información que podría ser necesaria para hacer un programa que calcule la materia necesaria para obtener una cantidad específica de cobre. A demás significan gastos para la empresa que se dedique a esta actividad.
Anote sus conclusiones generales de esta práctica.
La estequiometría nos sirve para calcular y conocer la cantidad de materia de los productos que se forma a partir de los reactivos.
En el caso de esta práctica, partimos que los reactivos son 5 gr. de CuSO4 y 1 gr. De Fe2 98.5 % de pureza. Durante la práctica, el reactivo limitante es el Fe2 ya que, durante la reacción química es el que se agota primero. Al hacer cálculos estequiométricos indicados en la pregunta 4 del cuestionario, obtenemos la cantidad de cobre esperada; esto porque debemos partir de la ley “la materia no se crea ni se destruye, solo se transforma” en otras palabras, todo lo que entra debe salir. Es por eso que la ecuación química debe estar balanceada. Esta reacción es de sustitución simple y es endotérmica, ya que para efectuarse requerimos de energía calorífica. También se calcula la eficacia de nuestro experimento.
BIBLIOGRAFÍA
Raymond Chang,
Química
Ed. Mc Graw Hill
7a Edición, Pág. 47
Diccionario Enciclopédico
Ed. Océano, Edición 1995
H. D. Crock Ford, Samuel B. Knight
Fundamentos De Físico-Química
E.D. Continental S. A. De C. D.
México, Pag. 19 - 21
David P. Shoemaker, Carl W. Garland
Experimentos De Físico-Química
E. D. Hispano Americana
Pag. 168, 583.
Paul E. Tippens
Física, Conceptos Y Aplicaciones
Ed. Mc Graw Hill, 5a Edición
México 1996, Pág. 310-312.
Smoo Robertt, Price Jack.
Química: Un curso moderno
Ed. CECSA, 12a Edición
México 1990, Pág. 348-349.
Paul Ander, Anthony J. Sonsea
Principios de Química. Introducción a los conceptos básicos.
Ed. Limusa, Pág. 413
Guillermo Garzón G
Fundamentos de Química General
Ed. Mc. Graw Hill, Pág. 144
DAUB William G., SEESE William S.
“Quimica”
Ed. Prentice-Hall Hispanoamericana S. A. 320-321.
http://www.lafacu.com/apuntes/quimica/esta_mate/default.htm
Nota: para efectos de cálculo, solo se considera al reactivo limitante, no al exceso.
111.68 g/mol
2(159.54) g/mol
2(151.84) g/mol
127.08 g/mol
Pesos Atómicos.
Cu = 63.54 g/mol
S = 32 g/mol
O = 16 g/mol
Fe = 55.84 g/mol
111.68 g/mol
2(159.54) g/mol
2(151.84) g/mol
127.08 g/mol
Pesos Atómicos.
Cu = 63.54 g/mol
S = 32 g/mol
O = 16 g/mol
Fe = 55.84 g/mol
Productos
Reactivos
Descargar
| Enviado por: | Juan Manuel Moreno Caudillo |
| Idioma: | castellano |
| País: | México |