Química
Equilibrio químico
Química 2ª bach : teoría
tema 4: equilibrio. Químico
Introducción
Vamos a estudiar el siguiente proceso
I2 (s) I2 (g) ( Sublimación )
En un recipiente abierto
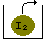
El yodo se sublima al elevar la T sin poder volver a solidificarse: es un proceso irreversible
En un recipiente cerrado
Siempre queda algo de Yodo sólido: Esto ocurre xq cuando se sublima suficiente yodo (Hay mucho yodo gas en el ambiente) empieza a producirse la sublimación inversa, y se llega al equilibrio (se producen igualmente ambas sublimaciones)
Las reacciones químicas son también irreversibles o reversibles, y tb. en ellas se alcanza el equilibrio químico
Como y cuando se alcanza el eq. Químico
N2O4 ![]()
2NO2 NO2 = Rojo N2O4 = Incoloro
Al producirse la reacción el color dentro del recipiente se vuelve un poco rojo, pero al cabo de un rato ya no se produce cambio de color: las concentraciones de ambos gases permanecen cte . por que se alcanzado el eq : las velocidades de ambas reac son iguales.
La mayoría de las reac son reversibles, pero en algunas el eq está muy desplazado0 hacia la izquierda o la derecha
Constante de equilibrio. Ley de acción de masas
deducción de la cte de equilibrio
aA +bB ![]()
cC + Dd
Hemos concluido que en el equilibrio las V son iguales. En el tema anterior vimos q la eq de velocidad es V =K velocidad (v) [A ]a [B] b como Vd =Vi (V directa = V inversa) se concluye que K v directa [A ]a [B] b = K v inversa [C ]c [D] d O:
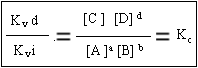
Enunciado de la ley de acción de masas
Las Kc varían según como esté ajustada la reacción así la Kc de N2 + 3H2 ![]()
2nh3 no es la misma que la de ½ N2 + 3/2 H2 ![]()
nh3 , por lo tanto nos tienen q dar la reac ajustada
Otra forma de expresar la constante de equilibrio
Esta se basa en la P y no en las concentraciones de los reactivos por ejemplo en la reacción N2 + 3H2 ![]()
2nh3
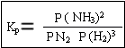
Relación entre Kp y Kc
PV = NRT
P = (N/V) RT
P = CRT sustituyendo en la ecuación de la Kp
Kp = Kc (RT)An
Información q proporcionan las cte de equilibrio
Al saber la K de una reacc reversible se pude calcular:
A )El rendimiento de una reacción
La Kc es directamente proporcional al rendimiento
b) El sentido de avance de la reacción dadas las concentraciones de las sustancias
Dado el equilibrio aA +bB ![]()
cC + dD, se trata de calcular las concentraciones en el eq. Si no lo están se calcula el cociente de reacción :
Si Q = Kc Está en equilibrio
Si Q > Kc Hacia la izquierda
Si Q < Kc Hacia la derecha
c) Grado de disociación-->[Author:E]
[AB] disociado
AB inicial
No tiene unidad
Factores que afectan al equilibrio
variación de la C de uno de los componentes del equilibrio
Dado el eq aA +bB ![]()
cC + +dd debe permanecer cte si vemos la fórmula de la Kc veremos q si aumenta uno de los reactivos , el reto de ellos ha de bajar, y los productos aumentaran como consecuencia de esto. La Kc es la misma xq no aumenta la T
Variación de la presión total (solo con gases)
Si la P disminuye el V aumenta y viceversa, para esto hay que sustituir en la formula de la Kc [A ] por (moles de A)/V y a partir de aquí deducir La P tb aumenta cuando introducimos un gas inerte en el recipiente
Variación de la temperatura
Presencia de catalizadores
Cuando añadimos un catalizador se acelera igualmente la reacc directa y la inversa, lo único q pasa es q el eq se alcanza antes
obtención industrial del amoniaco
La reacc de síntesis del de nh3 es N2 + 3H2 ![]()
2nh3
METODO DE HABER
La AH se este proceso es -92 Kj, y la Kc es muy alta , con lo que a T ambiente se podría decir que es rentable, xo esta es muy lenta , así que tenemos que T ambiente la V es muy baja, xo se alcanza el equilibrio. Esto se soluciona aumentando la P a 200 o 300 atm el equilibrio va hacia la derecha(favorece), así que se trabaja a T media y añadiendo un catalizador para acelerar además se va quitando nh3 mientras se produce.
Equilibrio sólido liquido
Estudiamos las reacc entre sólidos e Iones en disolución q dan a reacc de precipitación
a) Solubilidad
Solubilidad (S) = C (moles / L) soluto cuando esta saturada
Hay sales solubles (S > 0,01 mol / L) que se disocian enteras o (S < 0,01 mol / L) insolubles de las que se disocia poco y en las que existe un equilibrio entre sólido e Iones en disolución
Factores q afectan a la S en compuesto Iónico
TEMPERATURA
Las sales están compuestos por iones y cationes, si aumenta la T tb lo hace la vibración de estos, y por lo tanto lo enlace son + débiles y se disuelve más
FACTOR ENERGÉTICO
La solvatación iónica es un proceso exotérmico (AH = -80 Kj), esto nos hace suponer q los procesos exotérmicos son favorables
FACTOR ENTRÓPICO
Si la entropía aumenta la solubilidad también
Producto de solubilidad
Dado el eq aA +bB ![]()
cC +dD en el que algunas sustancias están disueltas y otras sólidas la concentración de los sólidos no varía, por esto al pasar la concentración de los sólidos con la Ks queda la Kc
c) Relación entre S y Ks
Formación de precipitados
Formulas

aA +bB ![]()
cC + dD
N2 + 3H2 ![]()
2nh3
aA +bB ![]()
cC + dD
Kp = Kc (RT)An
[AB] disociado
AB inicial
![]()
![]()

![]()
![]()

![]()
![]()
Descargar
| Enviado por: | Twalin |
| Idioma: | castellano |
| País: | España |
