Veterinaria
Enziamas
ENZIMAS
Los enzimas son biocatalizadores que facilitan y aceleran las reacciones químicas en los seres vivos, disminuyen la energía de activación que se necesita para que tengan lugar, permitiendo que se produzcan a velocidades y temperaturas adecuadas.
CARACTERISTICAS
1.- Como catalizadores que son , no se consumen actuan con su presencia y se necesitan cantidades pequeñas. EFICACIA CATALITICA
2.- Son muy específicos. Tienen Especificidad de reaccion y sustrato
3.- Actiuan en Condiciones fisiologicas (pH, Tª Presion)
4.- No forman subproductos
4.- Facilitan las reacciones porque aumentan la velocidad de reacción, se obtiene la misma cantidad de producto en memos tiempo
Aceleran la velocidad a la que se alcanza el equilibrio y lo consiguen disminuyendo la energia de activacion
ESTRUCTURA MOLECULAR:
Son proteínas globulares, su tamaño es muy grande, son solubles en agua y se difunden fácilmente en los líquidos orgánicos .Dos tipos: holoproteínas están formadas únicamente por una o varias cadenas de aminoácidos y. heteroproteínas. son la mayoría, se denominan HOLOENZIMAS. En ellas se diferencia: una parte proteica llamada apoenzima y una parte no proteica denominada cofactor.
El cofactor puede ser de distinta naturaleza:
1.- Cationes Metálicos como: Fe++, Mg2+, Cu2+
2.-Moléculas Orgánicas Complejas, en este caso se denominan:
•Coenzimas si se unen débilmente y de forma temporal al apoenzima, l NAD+, FAD
•Grupo prostético si se unen mediante enlaces covalente y de forma permanente al apoenzima
ISOENZIMAS: Son Distintas formas de una misma enzima, es decir enzimas homologas presentes en un mismo organismo.
Cada isoenzima presente en un tejido diferente o en un momento distinto del desarrollo.
Calatizan la misma reacción pero con pequeñas diferencias ( de estructura, distintos valores de Km y/o Vmax y distintas propiedades reguladoras).
Estan codificadas por distintos genes, tienen diferentes propiedades FQ y diferente regulacion.
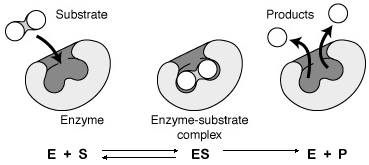
CINETICA DE LAS REACCIONES ENZIMATICAS E+SESEPE +P
Dos fases: 1ª) El sustrato (reactivos) se fija específicamente al enzima, formándose el complejo enzima-sustrato. E + S .--> ES
La unión entre el enzima y el sustrato se debe a enlaces débiles (puentes de hidrógeno, atrac electrost) La unión se produce en una zona del enzima denominado centro activo.
El centro activo es una pequeña región de la superficie del enzima con forma de hueco y cuya estructura tridimensional se adapta a la estructura complementaria del sustrato. Este centro activo esta formado por: aminoácidos de unión son los que le unen al sustrato y aminoácidos catalíticos son los que realizan la acción enzimática..
Una vez que el enzima se une al sustrato mediante los aminoácidos de unión, actúan sobre él los aminoácidos catalíticos que serán los que producen la ruptura de enlaces y la formación de otros nuevos, transformando el sustrato en producto. ESEP
Cuando el enzima presenta un cofactor, este se localiza en el centro activo.
2ª) Liberación de los productos. Una vez producida la acción enzimática, el complejo enzima-sustrato se desintegra quedando libre el enzima, podrá volver a actuar y, el sustrato convertido en producto. EPE+P
RESUMEN: CONCEPTOS CLAVE
-Centro activo: Parte de la enzima esencial para que la reacción se produzca.
• Grupos contactantes
• Grupos catalíticos
-Enzima-sustrato: complementariedad inducida. Lo Complementariedad primaria que aumenta al formarse el complejo ES.
-Quimotripsina: Serín proteasa.
• Tres AA catalíticos: Asp, His, Ser (tríada catalítica)
• La carga del Asp se transfiere a la Ser por medio de la His (relé de carga)
• La Ser ataca al sustrato
Tripsina enzima específica ya que liga posiciones del carboxilo de residuos Arginina (Arg) o Lisina (Lys)
FACTORES QUE INFLUYEN EN AL ACTIVIDAD ENZIMATICA:
La eficacia de un enzima se mide por la velocidad de transformación de sustrato a producto.
Y la velocidad de reacción por el nº de moléculas de sustrato transformadas por unidad de tiempo.
La velocidad de reacción depende de:
1.- CONCENTRACION DEL SUSTRATO y
2.- pH y Tª
3.- Activadores e Inhibidores
•CONCENTRACION DEL SUSTRATO
En toda reacción catalizada por un enzima, si se mantiene constante la concentración del E, la velocidad de la reacción aumenta exponencialmente al incrementarse la concentración del sustrato, ya que al existir más moléculas de sustrato es más probable el encuentro con el enzima y la formación del complejo E-S.
Este aumento de velocidad es rápido para concentraciones bajas de sustrato y, a medida que este aumenta, se va haciendo más lento hasta que la concentración del sustrato alcanza un cierto valor, a partir del cual, aunque aumente la concentración del mismo, no aumenta la velocidad de la reacción. Esto es debido a que el enzima esta saturada por el sustrato; es decir, todas las moléculas del enzima están unidas al sustrato formando el complejo E-S. Cuando ocurre esto, se dice que la reacción ha alcanzado la velocidad máxima.
Al seguir la velocidad de aparición de producto (o de 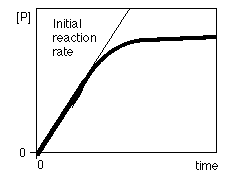
desaparición del sustrato) en función del tiempo se obtiene la llamada curva de avance de la reacción. A medida que la reacción transcurre, la velocidad de acumulación del producto va disminuyendo porque se va consumiendo el sustrato de la reacción
Para evitar esta complicación se procede a medir la velocidad inicial de la reacción (v0). La velocidad inicial de la reacción es igual a la pendiente de la curva de avance a tiempo cero De esta forma, la medida de v0 se realiza antes de que se consuma el 10% del total del sustrato, de forma que pueda considerarse la [S] como esencialmente constante a lo largo del experimento. Además, en estas condiciones no es necesario considerar la reacción inversa, ya que la cantidad de producto formada es tan pequeña que la reacción inversa apenas ocurre. De esta forma se simplifican enormemente las ecuaciones de velocidad.
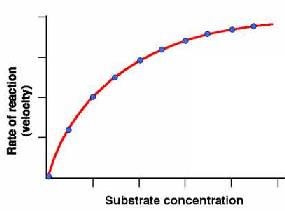
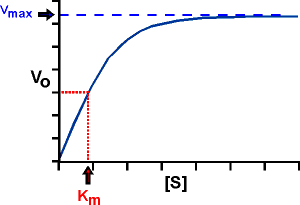
Para estudiar la cinética enzimática se mide el efecto de la concentración inicial de sustrato sobre la velocidad inicial de la reacción, manteniendo la cantidad de enzima constante. Si representamos v0 frente a [S]0 obtenemos una gráfica como la de la Figura de la derecha. Cuando [S]0 es pequeña, la velocidad inicial es directamente proporcional a la concentración de sustrato, y por tanto, la reacción es de primer orden. A altas [S]0, el enzima se encuentra saturada por el sustrato, y la velocidad ya no depende de [S]0. En este punto, la reacción es de orden cero y la velocidad es máxima (Vmax).
MODELO CINÉTICO DE MICHAELIS-MENTEN
Para explicar la relación oservada entre la velocidad inicial (v0) y la concentración inicial de sustrato ([S]0) Michaelis y Menten propusieron que las reacciones catalizadas enzimáticamente ocurren en dos etapas: En la primera etapa se forma el complejo enzima-sustrato y en la segunda, el complejo enzima-sustrato da lugar a la formación del producto, liberando el enzima libre:
En este esquema, k1, k2 y k3 son las constantes cinéticas individuales de cada proceso y también reciben el nombre de constantes microscópicas de velocidad. Según esto, podemos afirmar que:
v1 = k1 [E] [S]
v2 = k2 [ES]
v3 = k3 [ES]
Se puede distinguir entre enzima libre (E) y enzima unido al sustrato (ES), de forma que la concentración total de enzima, [ET], (que es constante a lo largo de la reacción) es:
[ET] = [E] + [ES]
Como [E] = [ET] - [ES], resulta que: v1= k1[S] [ET] - k1 [S] [ES]
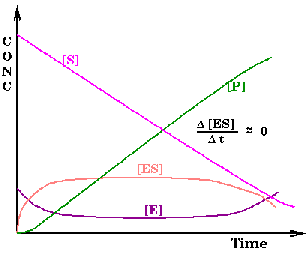
Este modelo cinético adopta la hipótesis del estado estacionario, según la cual la concentración del complejo enzima-sustrato es pequeña y constante a lo largo de la reacción (Figura de la derecha).
Por tanto, la velocidad de formación del complejo enzima-sustrato (v1) es igual a la de su disociación (v2+ v3):
v1 = v2 + v3
Además, como [ES] es constante, la velocidad de formación de los productos es constante:
v = v3 = k3 [ES] = constante.
Como v1=v2+v3, podemos decir que:
k1[S] [ET] - k1 [S] [ES] = k2 [ES] + k3 [ES]
Despejando [ES], queda que:
, siendo , en donde la expresión (k2+k3)/k1 se ha sustituído por KM, o constante de Michaelis-Menten. Por lo tanto, en el estado estacionario, la velocidad de formación del producto es:
v = v3 = k3 [ES] =
Para cualquier reacción enzimática, [ET], k3 y KM son constantes. Vamos a considerar dos casos extremos:
-
A concentraciones de sustrato pequeñas ([S] << KM) v = (k3 [ET]/KM) [S]. Como los términos entre paréntesis son constantes, pueden englobarse en una nueva constante, kobs, de forma que la expresión queda reducida a: v = kobs [S], con lo cual la reacción es un proceso cinético de primer orden.
-
A concentraciones de sustrato elevadas ([S] >> KM), v = k3 [ET]. La velocidad de reacción es independiente de la concentración del sustrato, y por tanto, la reacción es un proceso cinético de orden cero. Además, tanto k3 como [ET] son constantes, y nos permite definir un nuevo parámetro, la velocidad máxima de la reacción (Vmax): Vmax = k3 [ET], que es la velocidad que se alcanzaría cuando todo el enzima disponible se encuantra unido al sustrato.
Si introducimos el parámetro Vmax en la ecuación general de la velocidad, (la fórmula recuadrada anteriormente), obtenemos la expresión más conocida de la ecuación de Michaelis-Menten:
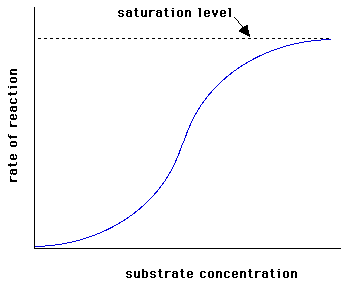
Hay enzimas que no obedecen la ecuación de Michaelis-Menten. Se dice que su cinética no es Michaeliana. Esto ocurre con los enzimas alostéricos, cuya gráfica v frente a [S] no es una hipérbola, sino una sigmoide (Figura de la derecha). En la cinética sigmoidea, pequeñas variaciones en la [S] en una zona crítica (cercana a la KM) se traduce en grandes variaciones en la velocidad de reacción.
MOTIVOS QUE HACEN DE KM UN PARÁMETRO CINÉTICO IMPORTANTE
La constante de Michaelis-Menten (KM) es un parámetro cinético importante pór múltiples razones:
-
KM es la concentración de sustrato para la cual la velocidad de reacción es la mitad de la velocidad máxima. En efecto, si KM = [S], la ecuación de Michaelis-Menten se reduce a: v = Vmax/2.
-
El valor de KM da idea de la afinidad del enzima por el sustrato: A menor KM, mayor afinidad del enzima por el sustrato, y a mayor KM, menor afinidad. Este hecho tiene fácil explicación si tenemos en cuenta que KM se define como (k2+k3/k1), donde las reacciones 2 y 3 destruyen el complejo ES, mientras que la reacción 1 lo forma. Así, si KM es grande, el complejo ES es inestable pues predomina la tendencia a destruirlo (poca afinidad hacia el sustrato), y si KM es pequeña, el complejo ES es estable, ya que predomina la tendencia a formarlo (gran afinidad hacia el sustrato).
-
La KM del sustrato natural es menor que la de los sustratos análogos. Si dos sustratos del mismo enzima tienen distinta KM, el que presente mayor KM tiene menor afinidad por el enzima, y la reacción transcurre siempre a menor velocidad que con el sustrato de menor KM, salvo a concentraciones saturantes de sustrato, donde la v = Vmax.
-
Los valores de KM de muchos enzimas son próximos a los de la concentración fisiológica de sus sustratos, de forma que pequeñas variaciones en la [S] pueden suponer grandes cambios en la velocidad de toda una ruta metabólica.
CÁLCULO DE LA KM Y DE LA Vmax DE UN ENZIMA

La representación gráfica de la ecuación de Michaelis-Menten (v0 frente a [S]0) es una hipérbola La Vmax corresponde al valor máximo al que tiende la curva experimental, y la KM corresponde a la concentración de sustrato a la cual la velocidad de la reacción es la mitad de la Vmax.

Para determinar gráficamente los valores de KM y Vmax es más sencillo utilizar la REPRESENTACIÓN DOBLE RECÍPROCA (1/v0 frente a 1/[S]0), ya que es una línea recta. Esta representación doble recíproca recibe el nombre de representación de Lineweaver-Burk (Figura de la derecha). Es una recta en la cual:
-
La pendiente es KM/Vmax
-
La abscisa en el origen (1/v0 = 0) es -1/KM
-
La ordenada en el origen (1/[S]0 = 0) es 1/Vmax
De esta forma, a partir de los datos experimentales se puede calcular gráficamente, los valores de KM y Vmax de un enzima para diversos sustratos.
RESUMEN: CONCEPTOS CLAVE
-Cinética de las reacciones enzimáticas. Saturación
-
V0 = Vmax [S] / Km + [S]
-Km:
-
Concentración de sustrato para la cual la velocidad es
la mitad de la máxima
-
Medida inversa de la afinidad Ez-sustrato
-Determinación de Km y Vmax:
Representación de los dobles recíprocos
• Punto de corte en OX: - 1/Km
• Punto de corte en OY: 1/Vmax
INHIBICION ENZIMATICA
La actividad enzimática se puede inhibir, es decir, reducir o eliminar la actividad enzimática o catalítica de enzimas específicas.
La inhibición puede ser:
IRREVERSIBLE - el inhibidor se une covalentemente a la enzima, casi siempre a un grupo de la cadena lateral de los amino ácidos en el foco activo. La enzima queda inactiva permanentemente.
Por ejemplo, la aspirina o ácido acetilsalicílico (ASA) inhíbe irreversiblemente la acción de la sintetasa de prostaglandina:
Algunas prostaglandinas producen dolor e inflamación. Al quedar bloqueada su síntesis se reduce la inflamación y se alivia el dolor.

El acido folico (molecula izda) y el metotrexato drogas anticancerigena tienen estructuras semejantes. Como resultado el metrotrexano es un inhibidor competitivo de muchas enzimas que utilizan folico (quimioterapia).
LA PENICILINA Y LA ASPIRINA actúan como Los inhibidores irreversibles reaccionan con la enzima y forman conexiones covalentes con la cadena polipeptidica.
REVERSIBLE: el inhibidor puede disociarse de la enzima porque no se une por enlaces covalentes. Esta inhibición puede ser competitiva o no-competitiva.
(A)INHIBICIÓN COMPETITIVA - el inhibidor competitivo es muy similar al sustrato normal de la enzima. Dada esa similitud estructural, este tipo de inhibidor se une reversiblemente al foco activo de la enzima.
El inhibidor forma un complejo enzima-inhibidor equivalente al complejo enzima-sustrato:
Como hay un equilibrio, entonces la rapidez de ambas reacciones se iguala:
R1 = R-1
por lo que:
k1[ E ][ I ] = k-1[ EI ]
de aquí que:
donde KI es la constante de disociación de EI (o constante de inhibición). Esta constante se usa para describir cuán fuerte se une el inhibidor a la enzima.
De acuerdo a esta expresión,
por lo que [EI] es directamente proporcional a [I] e inversamente proporcional a KI.
O sea, a mayor valor de KI , más débil la unión del inhibidor con la enzima, el complejo EI se disocia fácilmente, y el foco activo vacante puede estar disponible para unirse a su sustrato.
No hay reacción productiva mientras el inhibidor se une a la enzima, por lo que la actividad de la enzima declina.
El efecto del inhibidor competitivo en la actividad enzimática se revierte por un aumento en la concentración del sustrato: a altas concentraciones todos los focos activos se combinan con el sustrato y la actividad enzimática se normaliza.
La Vmax se mantiene constante con o sin inhibidor competitivo. Sin embargo, cuando está presente el inhibidor Km aumenta y Vmax nunca se alcanza:
Por la gráfica de Lineweaver Burk observamos que, como la inhibición competitiva no afecta la Vmax: el corte con el eje en "y" (1/Vmax) es identico para todas las posibles concentraciones del inhibidor competitivo; todas la líneas intersectan el el mismo punto en el eje de "y":
A baja [S] ([S] <<Km), la enzima está predominantemente en la forma libre, E. El inhibidor competitivo puede combinarse con E, por lo que la presencia del inhibidor disminuye la velocidad cuando [S] es baja. A estas condiciones la expresión de velocidad es:
vo = Vmax[S]/Km.
Como la velocidad inicial es proporcional a Vmax/Km, la presencia del inhibidor afecta la pendiente de la grafica de Lineweaver-Burke, que es precisamente el recíproco de Vmax/Km,o sea,(Km/Vmax). El valor de la pendiente aumenta. Tambien hay un aumento en Km segun aumenta [I].
Aumentando [I] causa un aumento en Km/Vmax. Por lo tanto, en la inhibición competitiva se afecta la pendiente pero no hay efecto en Vmax.
(B) INHIBICIÓN NO-COMPETITIVA: el inhibidor se combina con la enzima en un lugar distinto al foco activo. Tanto EI como EIS se forman:
La unión del inhibidor afecta la configuración tridimensional de la enzima y bloquea la reacción. Este tipo de inhibidor no compite directamente con el sustrato para unirse a la enzima (no afecta la unión ES), por lo tanto, este tipo de inhibición no es reversible cuando aumenta la concentración del sustrato.
Esta inhibición disminuye la Vmax según aumenta [ I ], pero no afecta Km (la enzima puede unirse al sustrato):
Esto implica que se afecta la pendiente Km/Vmax y el intercepto en "y" en la gráfica de Lineweaver Burk:

Las líneas de diferentes [ I ] intersectan en puntos distintos del eje OY Sus pendientes son diferentes, pero es el mismo Km en todos los casos (intersectan el mismo punto del eje OX).
RESUMEN: CONCEPTOS CLAVE
- La actividad de las enzimas está regulada: para que su funcionamiento se ajuste en cada momento a las necesidades celulares
Inhibición competitiva: La producen compuestos parecidos al sustrato:
• Disminuyen la afinidad (aumenta Km), no modifican Vmx
• Revierte a concentraciones altas de SUSTRATO
Inhibición no competitiva: La producen compuestos noparecidos al sustrato:
• Disminuyen la Vmx, no modifican la afinidad (igual Km)
• No revierte a concentraciones altas de SUSTRATOico (izquierd
ENZIMAS ALOSTÉRICAS
Las enzimas alostéricas como las clásicas reconocen y se asocian en su centro activo a un sustrato específico y catalizan su conversión en productos. Pero además estas enzimas tienen la propiedad de reconocer selectivamente a uno o varios compuestos distintos del sustrato cuya asociación reversible con la proteina tiene por efecto modificar su actividad frente al sustrato, ya sea activándolo o inhibiéndolo, sin participar en nada en la reacción en sí.
Dichos compuestos que reciben el nombre de efectores o moduladores alostéricos interaccionan con la enzima en un sitio distinto y generalmente distante del centro activo que recibe el nombre de sitio alostérico.
Se acepta que la asociación del efector alostérico a la proteina en el sitio alostérico produce una alteración de la configuración espacial de la enzima (transición alostérica) que se transmite al centro activo modificándolo de tal manera que la actividad de la enzima aumenta o disminuye según se trate de un efector o modulador alostérico positivo o negativo respectivamente.
Las enzimas alostéricas tienen por lo general una estructura proteica más compleja que la de las enzimas no regulables, están constituídas por subunidades. Además puden responder a la acción de más de un efector alostérico (positivoso activadores y negativoso inhibidores), en cuyo caso poseen en su estructura un sitio alostérico distinto para cada uno de ellos Desde el punto de vista metabólico, estas enzimas, que generalmente catalizan reacciones prácticamente irreversibles, se encuentran ubicadas estratégicamente en
ciertos puntos de las vías metabólicas, de tal manera que su regulación coopera en forma efectiva en la economía general de la célula. Así por ejemplo las encontramos como primera enzima de una secuencia de reacciones de tal manera que su activación o inhibición aumente o disminuya respectivamente la velocidad de toda la vía metabólica involucrada de acuerdo a las necesidades de la célula.
- Las enzimas alostéricas presentan estructura cuaternaria.
- Tienen diferentes sitios activos, unen más de una molécula de sustrato
- La unión del sustrato es cooperativa
- La curva de velocidad en función de la (s) presenta una forma sigmoidea
- Pequeños cambios en la concentración del modulador se asocian con grandes cambios en la actividad de la enzima
REGULACIÓN ENZIMÁTICA
Cuanto más se avanza en el conocimiento de la bioquímica celular, especialmente por los aportes hechos en los últimos años por la biología molecular, más se afianza el concepto enunciado oportunamente por Changeux, de equiparar el funcionamiento de una célula al de una “verdadera fábrica química automática diseñada para aprovechar lo más eficientemente la energía disponible”. En efecto, en una fábrica automática coexisten varias líneas de producción que trabajan simultáneamente en forma concertada y que se regulan a sí mismas y entre ellas por medio de controles automáticos, consistentes en circuitos electrónicos específicos de retroalimentación.
Estos principios pueden aplicarse también a los seres vivos, Así, el funcionamiento de la célula más sencilla, implica la existencia de una verdadera maraña de procesos metabólicos consistentes en secuencias de reacciones químicas catalizadas por enzimas específicas. Cada una de estas vías metabólicas sería equiparable a las mencionadas líneas de producción de la fábrica automática y las máquinas elementales de la fábrica celular serían las mencionadas enzimas. Existen en principio cuatro formas posibles de que la célula controle la velocidad de funcionamiento de dichas vías metabólicas:
1) DISPONIBILIDAD DE SUSTRATO
Como ya hemos indicado, la actividad de la enzima guarda proporcionalidad con los niveles de sustrato. Estos determinan la mayor o menor velocidad en la actividad enzimática. Al aumentar la concentración de sustrato, en la célula aumenta su utilización y viceversa. Generalmete el sustrato debe ingresar a la célula o al interior de una organela. Ejemplo: β-oxidación y síntesis de cuerpos cetónicos.
2) MODIFICACIÓN COVALENTE
Muchas enzimas son reguladas por el agregado o sustracción de grupos unidos covalentemente a la misma.
La regulación covalente más frecuente se realiza por modificación de los residuos de tirosina, serina y/o treonina de las enzimas por un proceso de unión o eliminación de grupos fosfatos. Existen también enzimas cuya actividad es modulada por la inserción covalente de otros grupos., como se muestra en la siguiente tabla.
| | |
3) MODULACIÓN ALOSTÉRICA.
Ya se describió anteriormente. Algunos casos particulares dan origen a diferentes modos regulatorios. En algunas vías metabólicas, la enzima que cataliza la primera etapa de la serie suele ser inhibida por el producto de la última.
Cuando la concentración de ese producto final aumenta, ello indica que su elaboración excede las necesidades y se frena el funcionamiento de la vía reduciendo la actividad de la enzima reguladora. Se habla de un proceso de retroinhibición. También puede suceder que una enzima sea estimulada por algún agente que se acumula en el medio. Cuando existe un exceso de sustrato, él mismo promueve su utilización activando a la enzima.
RESUMEN: CONCEPTOS CLAVE
-Las enzimas con estructura cuaternaria tienen regulación ALOSTÉRICA:
• Formas de alta y baja afinidad por S
• Los ligandos inducen cambios a una u otra estructura
Cinética: SIGMOIDEA pequeñas (S) producen grandes aumentos de Velocidad.
• Inhibidores alostéricos: disminuyen la afinidad (aumenta K0,5). Inducen cambio a forma tensa.
• Activadores alostéricos: aumentan la afinidad (disminuye K0,5). Inducen cambio a forma relajada.
Descargar
| Enviado por: | Mikel Mechanix |
| Idioma: | castellano |
| País: | España |
