Química
Dureza del agua
Universidad Gran Mariscal de Ayacucho
Facultad de Ingeniaría
Escuela de Ingeniería Ambiental y de los Recursos Naturales
Núcleo- Maturín
1/02/2005
INDICE
INTRODUCCIÓN
INTRODUCCIÓN
Agua, nombre común que se aplica al estado líquido del compuesto de hidrógeno y oxígeno H2O. El agua pura es un líquido inodoro e insípido. Tiene un matiz azul, que sólo puede detectarse en capas de gran profundidad. El agua es uno de los agentes ionizantes más conocidos. Puesto que todas las sustancias son de alguna manera solubles en agua, se le conoce frecuentemente como el disolvente universal. El agua combina con ciertas sales para formar hidratos, reacciona con los óxidos de los metales formando ácidos y actúa como catalizador en muchas reacciones químicas importantes.
En su circulación por encima y a través de la corteza terrestre, el agua reacciona con los minerales del suelo y de las rocas. Los principales componentes disueltos en el agua superficial y subterránea son los sulfatos, los cloruros, los bicarbonatos de sodio y potasio, y los óxidos de calcio y magnesio. Las aguas de la superficie suelen contener también residuos domésticos e industriales.
Una característica del agua es su Dureza, la cual se debe ha que la misma esta compuesta por iones y cationes, más específicamente el magnesio y el carbonato de calcio.
Esta propiedad del agua es la que se estudiara en este informe; hay que decir que la dureza del agua, además de ser la suma de las concentraciones de calcio y magnesio, es la propiedad que tiene de precipitar el jabón y la formación de sedimentos y costras en tuberías.
El agua se clasifica generalmente en términos al grado de dureza que posea de la siguiente forma:
0 a 75mg/L ! Suaves.
75 mg/L a 150 mg/L ! Poco Duras.
151 mg/L a 300 mg/L ! Duras.
301 mg/L a más ! Muy Duras.
OBJETIVO GENERAL
- Tomar la dureza Total, Cálcica y Magnésica de unas muestras de agua del río de Boquerón de Amana y el bajo guarapiche, comparada con una muestra de agua destilada.
OBJETIVOS ESPECIFICOS
-
Compara la Dureza de los dos ríos con las muestras de agua destilada mediante el uso de un indicador.
-
Conocer la Dureza Total y la Cálcica mediante el proceso de titulación.
-
Conocer la dureza magnésica a partir de la dureza total y cálcica.
-
Realizar la titulación en soluciones hasta observar un color similar al del testigo (blanco).
-
Estudiar las variaciones en la dureza de las distintas muestras de agua, para así hallar conclusiones.
MARCO TEORICO
Las impurezas suspendidas y disueltas en el agua natural impiden que ésta sea adecuada para numerosos fines. Los materiales indeseables, orgánicos e inorgánicos, se extraen por métodos de criba y sedimentación que eliminan los materiales suspendidos. Otro método es el tratamiento con ciertos compuestos, como el carbón activado, que eliminan los sabores y olores desagradables. También se puede purificar el agua por filtración, o por cloración o irradiación que matan los microorganismos infecciosos.
En la ventilación o saturación de agua con aire, se hace entrar el agua en contacto con el aire de forma que se produzca la máxima difusión; esto se lleva a cabo normalmente en fuentes, esparciendo agua en el aire. La ventilación elimina los olores y sabores producidos por la descomposición de la materia orgánica, al igual que los desechos industriales como los fenoles, y gases volátiles como el cloro. También convierte los compuestos de hierro y manganeso disueltos en óxidos hidratados insolubles que luego pueden ser extraídos con facilidad.
Encontramos la Dureza Permanente o Residual, la cual esta compuesta por Cloruro de Calcio, Sulfato de Calcio, Nitrato de Calcio, Cloruro de Magnesio, Sulfato de Magnesio y Nitrato de Magnesio. Las aguas que poseen esta dureza pueden ablandarse añadiendo carbonato de sodio y cal, o filtrándolas a través de ceolitas naturales o artificiales que absorben los iones metálicos que producen la dureza, y liberan iones sodio en el agua.
En el hogar se puede comprobar esto en la cantidad de depósitos de calcio en los recipientes que se utilizan para cocinar, comúnmente llamado “sarro”, el cual también puede apreciarse en los cristales de las peceras. Estas son parte de la dureza general ó gH.
El resto de las partes de gH consisten en sales que contienen baja solubilidad y por lo tanto son partes inestables en la dureza general. La dureza causada por estos componentes inestables es, a veces, llamada dureza temporal. Sin embargo es el término de “Dureza de Carbonatos” ó kH y esta formada por carbonatos de Calcio y Magnesio. La dureza de las aguas naturales es producida sobre todo por las sales de calcio y magnesio, y en menor proporción por el hierro, el aluminio y otros metales.
La que se debe a los bicarbonatos y carbonatos de calcio y magnesio se denomina dureza temporal y puede eliminarse por ebullición, que al mismo tiempo esteriliza el agua.
Los carbonatos de calcio y magnesio son de muy baja solubilidad. Sólo cuando el dióxido de carbono libre está presente, estas sales se disuelven significativamente como Bicarbonatos. Cuando el dióxido de carbono es removido, una precipitación de carbonatos de calcio y magnesio se formará y el kH bajará.
Existen varios métodos para ablandar el agua dura:
-
Uno es la filtración por resinas catiónicas, es decir, que deben desecharse una vez usadas. Existen otros tipos de resinas pero sólo son de intercambio iónico que eliminan iones de calcio y magnesio por iones de sodio.
-
Otro método es la mezcla con agua proveniente de una filtración por lo que se llama ósmosis inversa ó con agua de lluvia. Para esto se debe calcular la dureza del agua de lluvia y la del agua del grifo y poner las partes proporcionales para cada una, por lo general serian dos partes de agua de grifo por una de lluvia u ósmosis.
El agua blanda puede ser endurecida al adicionar Sulfato de Calcio lo cual incrementa la dureza permanente pero no el kH. Éste incrementará si se le filtra con Carbonato de Calcio, ó bien comprando algún tipo de suplemento comercial.
Encontramos diversos tipos de clasificación para las Durezas del agua, entre las cuales tenemos:
-
Agua blanda: Es la que contiene poca caliza, forma abundante espuma con el jabón, es decir agua predominante libre de iones calcio y magnesio.
-
Agua dura: Es la que contiene exceso de sales y forma poca espuma con el jabón, contiene iones calcio y magnesio y es inadecuada para algunos usos domésticos e industriales.
La dureza del agua se expresa como mg/L de carbonato de calcio (CaCO3).
Tipos de Dureza.
Anteriormente se menciono que los tipos de dureza que existían eran:
-
Dureza temporaria o dureza de carbonatos (
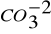
): constituida por carbonato ácido de calcio o magnesio. Estos bicarbonatos precipitan cuando se calienta el agua transformándose en carbonatos insolubles. -
Dureza Permanente: debida a la presencia de sulfatos (
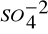
), nitratos (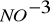
) y cloruros de calcio (CaCl2) y magnesio (MgCl2), esas sales no precipitan por ebullición. -
Dureza Total: es la suma de la dureza temporaria y la permanente.
El hierro, que produce un sabor desagradable en el agua potable, puede extraerse por medio de la ventilación y sedimentación, o pasando el agua a través de filtros de ceolita. También se puede estabilizar el hierro añadiendo ciertas sales, como los polifosfatos. El agua que se utiliza en los laboratorios, se destila o se desmineraliza pasándola a través de compuestos que absorben los iones.
Los olores y sabores desagradables del agua se eliminan por oxigenación. Las bacterias se destruyen añadiendo unas pocas partes por millón de cloro, y el sabor del cloro se elimina con sulfito de sodio. La dureza excesiva del agua, que la hace inservible para muchos usos industriales, se consigue reducir añadiendo cal débil o hidratada, o por un proceso de intercambio iónico, utilizando ceolita como ablandador. La materia orgánica en suspensión, con vida bacteriana, y la materia mineral en suspensión, se eliminan con la adición de agentes floculantes y precipitantes, como alumbre, antes del filtrado. La fluoración artificial del agua para consumo público se lleva a cabo en algunos países para prevenir la caída de los dientes.
La dureza del agua, debida a los iones de calcio y magnesio que forman compuestos insolubles, se elimina por intercambio iónico. Se filtra el agua pasándola por una ceolita artificial, como la permutita, y el sodio de la ceolita sustituye a los iones indeseables del agua. Cuando la ceolita se satura con los iones metálicos, se lava con una disolución de sal común que vuelve a restituir los iones de sodio.
Los métodos de intercambio iónico se han utilizado con importantes resultados en la separación (hasta ahora casi imposible) de los distintos elementos de las tierras raras (lantánidos), y para separar el plutonio del uranio y de los otros productos de fisión en la investigación sobre combustibles nucleares. Las técnicas de intercambio iónico contribuyeron a la primera identificación y separación del promedio, así como de varios elementos transuránicos. El hafnio, que se usa para fabricar filamentos de volframio, fue separado del circonio por el método de intercambio iónico con más eficacia que con cualquier otro método de separación química.
Las resinas sintéticas intercambiadoras de iones se emplean como filtros y acondicionadores para los radiadores de automóviles y otros sistemas refrigerantes. También se utilizan en la industria farmacéutica como antiácidos en el tratamiento de las úlceras pépticas, como absorbentes intestinales para el control de la diarrea, y como agentes para disminuir el sodio en el tratamiento de las jaquecas, las enfermedades de corazón y los edemas. En otras aplicaciones, las resinas se usan para preparar plasma sanguíneo, eliminando de la sangre el calcio productor de coágulos, y para aislar antibióticos.
MARCO EXPERIMENTAL
Experimento # 1
Dureza Total
Materiales y Sustancias:
-
Soporte Universal.
-
Pinza Mariposa.
-
Bureta.
-
Cilindro Graduado (50ml).
-
Pipeta (10ml).
-
Matraz Erlenmeyer de 250ml de cap. (5).
-
Solución Amortiguadora.
-
Indicador Negro de Eriocromo T.
-
Solución EDTA 0,02N.
-
Agua Destilada.
-
Agua del río bajo guarapiche.
-
Agua del río de Boquerón de Amana.
-
Tubo Capilar.
Procedimiento:
-
Se tomaron 5 matraces Erlenmeyer de 250ml previamente limpios y secos.
-
Se tomó un cilindro graduado en el cual se midieron 50ml de agua destilada, se trasvasó hacia uno de los matraces y se identificó como BDT (Blanco de dureza total).
-
Se tomaron los 4 matraces restantes y se colocó en cada uno 50ml de agua de chorro medida con el cilindro graduado, y se identificaron como M1DT (Muestra 1 de Dureza Total), M2DT (Muestra 2 de Dureza Total), M3DT (Muestra 3 de Dureza Total) y M4DT (Muestra 4 de Dureza Total) respectivamente.
-
Se le agregó 1ml de solución amortiguadora a cada matraz, medido con una pipeta limpia y seca.
-
Con un tubo capilar se tomó una medida aproximada de 0,02gr de indicador negro de Eriocromo T, el cual se le agregó a los matraces, se agitó hasta disolver completamente. El matraz BDT adquirió un color gris oscuro y las muestras un color fucsia.
-
Se añadió una pequeña cantidad de EDTA 0,02N en la Bureta para proceder a curarla, posteriormente se colocó sobre el Soporte Universal, sosteniéndolo con la pinza mariposa y se lleno con la solución de EDTA 0,02N, se abrió la llave de paso para purgar la misma, luego se agregó más EDTA 0,02N hasta enrazar a (0ml) para iniciar la titulación.
-
La solución Blanco tenía un color gris oscuro, por lo cual fue necesario agregarle una gota de EDTA 0,02N y agitar hasta que tomara la coloración azul que debió haber tomado desde el principio.
-
Se tomó el matraz M1DT con la mano derecha, y con la izquierda se manipuló la llave de paso, dejando caer gota a gota la solución EDTA 0,02N en el matraz, agitándose de manera constante y cuidadosa, hasta observar un cambio de color en la muestra, de fucsia a azul (viraje).
-
Seguidamente se realizó la titulación con el M2DT, M3DT, M4DT, repitiendo el proceso anterior.
-
Se tomó nota del volumen consumido en la bureta.
-
Este mismo proceso se llevó acabo con muestras de agua del río Guarapiche y de agua de Morichal.
Experimento # 2
Dureza Cálcica
Materiales y Sustancias:
-
Soporte Universal.
-
Pinza Mariposa.
-
Bureta.
-
Cilindro Graduado (50ml).
-
Pipeta (10ml).
-
Matraz Erlenmeyer 250ml (5).
-
Solución de NaOH 1N.
-
Indicador Murexida.
-
Solución EDTA 0,02N.
-
Agua destilada.
-
Tubo capilar.
Procedimiento:
-
Se tomaron 5 matraces Erlenmeyer de 250ml previamente limpios y secos.
-
Se tomó un cilindro graduado (50ml), en cual se midieron 50ml de agua destilada, la cual se trasvasó hacia uno de los matraces, el cual se identificó como BDC (Blanco de dureza cálcica).
-
Se tomaron los cuatro matraces restantes y se colocó en cada uno 50ml de agua de destilada, previamente medido con el cilindro graduado, y se identificaron como M1DC, M2DC, M3DC, M4DC (Muestra 1, 2, 3,4 de Dureza Cálcica).
-
Con una pipeta, previamente curada se midieron 2ml de NaOH 1N y se le añadió a cada matraz.
-
Se le agregó a cada matraz 0,2grs. de indicador Murexida, extraído con un tubo capilar, y se agitó hasta disolver completamente. El blanco o testigo tomo una coloración morada y las cuatro muestras una coloración rosada.
-
Por la titulación anterior la bureta ya se encontraba preparada, por lo tanto solo se procedió a enrazar con la solución de EDTA 0,02N.
-
Se inició la titulación, primeramente se tomó el matraz M1DC con la mano derecha y la llave de paso de la bureta con la mano izquierda. Se dejó caer gota a gota la solución de EDTA en el matraz, el cual se agitaba constantemente, hasta que se produjo el cambio de color, de rosado claro a morado.
-
Este proceso se repitió con las muestras restantes (M2DC, M3DC, M4DC).
-
Se anotaron los resultados arrojados por la titulación.
-
Igual que en el experimento anterior, este proceso se realizó con muestras de agua del río Guarapiche y el agua de Morichal.
Dureza Magnésica
- De la siguiente formula se despejo la Dureza Magnésica para hallar su valor:
Dureza Total = Dureza Cálcica + Dureza Magnésica, quedando entonces:
Dureza Magnésica = Dureza Total - Dureza Cálcica
RESULTADOS
Experimento # 1
Dureza Total
Las cantidades consumidas en las cuatro titulaciones fueron:
Titulación 1 M1DT: 6.4ml de EDTA 0,02N consumidos.
Titulación 2 M2DT: 6.7ml de EDTA 0,02N consumidos.
Titulación 3 M3DT: 6.4 ml de EDTA 0,02N consumidos.
c) Dureza Total = 6.7ml EDTA x 0,02 meq/ml x 50 mg/meq x 1000 ml/L
50ml de muestra
Dureza Total = 134 mg/L
Experimento # 2
Dureza Cálcica
Las cantidades consumidas en las cuatro titulaciones fueron:
Titulación 1 M1DC: 4.8 ml de EDTA 0,02N consumidos.
Titulación 2 M2DC: 4.5 ml de EDTA 0,02N consumidos.
Titulación 3 M3DC: 4.4 ml de EDTA 0,02N consumidos.
c) Dureza Cálcica = 4.4ml EDTA x 0,02 meq/ml x 50 mg/meq x 1000 ml/L
50ml de muestra
Dureza Cálcica = 88 mg/L
Dureza Magnésica = Dureza Total - Dureza Cálcica
Dureza Magnésica = 134mg/L - 88mg/L
Dureza Magnésica = 46mg/L
Comparación de Resultados con las otras muestras
| Muestra | Dt (mg/L) | Dc (mg/L) | Dm (mg/L) |
| Río Guarapiche | 134 | 88 | 46 |
| Morichal | 36 | 32 | 04 |
ANALISIS DE LOS RESULTADOS
Con los resultados obtenidos pudimos constatar que el agua del guarapiche tiene una dureza de 130 de mg/L, lo que la ubica en el grupo de las aguas poco duras. Y que es una dureza temporal ya que posee una mayor cantidad de iones de calcio que de magnesio.
Haciendo la comparación con las muestras del agua del río Morichal, nos damos cuenta que el tipo de agua que presenta ya que la del se ubica en el grupo de aguas suaves por poseer una dureza de 13,5mg/L, mientras que la de Morichal, a pesar de pertenecer al grupo de aguas poco duras, tiene menor concentración de iones calcio y una mayor de iones magnesio.
Con esto podemos ver que el agua de chorro es tratada con una mayor cantidad de calcio, porque este compuesto es temporal en el agua, ya que por un simple proceso de calentamiento se separa del agua. Mientras que las aguas de río pasan por lugares donde hay una mayor concentración de magnesio, arrastrándolo consigo debido a la erosión.
CONCLUSION
De las experiencias realizadas anteriormente podemos concluir que:
-La dureza del agua es causada por sales de Calcio y Magnesio. Sales que se incorporan al agua por ser sustancias presentes en los lugares por donde ellas corren. Ejemplo: el agua que corre entre rocas, ricas en sales de calcio, se va a convertir en un agua que presenta dureza, ya que por la erosión de las rocas estas sales se adhieren al agua.
- Que dependiendo el grado de dureza que posea el agua la podemos clasificar, generalmente, de la siguiente manera: Suaves, Poco Duras, Duras y Muy Duras.
- Que dependiendo el grado de concentración que posea de iones de calcio y de magnesio la dureza la podemos clasificar en: Dureza Temporaria o Dureza de Carbonatos, constituida por carbonatos ácidos de calcio o magnesio. Dichos bicarbonatos se precipitan cuando se calienta el agua transformándose en carbonatos insolubles. Dureza Permanente, es la que se origina por la presencia de sulfatos, nitratos y cloruros de calcio y magnesio. Esas sales no se precipitan por ebullición. Dureza Total, es la suma de la dureza temporaria y la permanente.
BIBLIOGRAFIA
-
CHANG, Raymond: Química. Cuarta Edición. Mc Graw. México, 1993.
Titulo: Dureza del Agua.
Fecha: 30/01/06
Hora: 6:42
-
Enciclopedia de consulta, Encarta 2005.
1
Descargar
| Enviado por: | Lanz |
| Idioma: | castellano |
| País: | Venezuela |
