Química
Difusión de gases
Difusión de gases
Índice.-
Resumen 3
Principios teóricos 3
Procedimiento experimental 4
Resultados 5
Ejemplo de cálculos 5
Discusión de resultados 6
Conclusiones y recomendaciones 6
Apéndice 7
Bibliografía 9
Cuestionario 10
1.- Resumen
La difusión, es decir, la mezcla gradual de las moléculas de un gas con moléculas de otro gas, en virtud de sus propiedades cinéticas, constituye una demostración directa del movimiento aleatorio. La difusión siempre procede de una región de mayor concentración a otra menos concentrada. A pesar de que las velocidades moleculares son muy grandes, el proceso de difusión toma una tiempo relativamente grande para complementarse. Por ello, la difusión de los gases siempre sucede en forma gradual. Además, puesto que la raíz de la velocidad cuadrática media de una gas ligero es mayor que la de una gas mas pesado, un gas ligero se difundirá a través de un cierto espacio mas rápido que un gas pesado.
2.- Principios teóricos
Difusión Gaseosa
Concepto.
Es el fenómeno por el cual las moléculas de un gas se distribuyen uniformemente el otro gas. También se establece como la capacidad de las moléculas gaseosas para pasar a través de aberturas pequeñas, tales como paredes porosas, de cerámica o porcelana que no se halla vidriada.
Ley de la Difusión Gaseosa
Fue establecida por Thomas Graham; quien manifiesta lo siguiente:
“en las mismas condiciones de presión y temperatura, las velocidades de difusión de dos gases son inversamente proporcionales a las raíces cuadradas de sus masas moleculares.”
Análisis:
Llamemos M1 a la masa de las moléculas de una especie y M2 a la masa de las moléculas de otra especie. Entonces, las energías cinéticas promedio de las moléculas de cada gas están dadas por las expresiones:

pues la temperatura es la misma. Dividiendo miembro a miembro tenemos que:
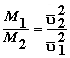
o sea que el cociente de la raíz cuadrada del cuadrado de la velocidad media para ambas especies es inversamente proporcional a la masa de esa especie. En fórmula:
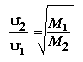
Como la masa es proporcional a la densidad y el cociente del miembro izquierdo es una medida de la rapidez con que las moléculas de una especie se desplazan respecto a las de la otra y esto es justamente el mecanismo subyacente a la difusión, esta ecuación es la expresión matemática de la ley de Graham.
3.- Procedimiento experimental
Materiales
-Un tubo de difusión de vidrio de diámetro uniforme y de determinada longitud
-Una regla graduada
-Huaype
-Un cronómetro
-Goteros (2)
-Barra de metal para la lindeza del tubo.
-Tapones de goma
Reactivos
-Ácido clorhídrico HCl
-Hidróxido de amonio NH4OH
Procedimiento
1.Instalar el equipo como se muestra en la figura:

2.Con los tapones cerrar los dos lados del tubo. (Tener el tubo en una superficie oscura).
3.Por uno de los dos agujeros agregar 5 gotas de NH4OH y por el otro cinco gotas de HCL y tapar los agujeros con pedazos de huaype.
4.Observar y controlar el tiempo en que se forma una especie de separación de color blanco el cual indica el punto de contacto de los dos gases.
5.Medir las distancias entre los orificios y el punto de contacto también el tiempo.
6.Limpiar el tubos de difusión. Volvemos a repetir el experimento dos o tres veces mas.
4.- RESULTADOS:
Experimento 1:
-
Tiempo: 49s.
-
Distancia del NH4OH(c)=20.8.
-
Distancia del HCl(c)=10.2.
Experimento 2:
-
Tiempo: 55s.
-
Distancia del NH4OH(c)=23.5.
-
Distancia del HCl(c)=7.5.
Experimento 3:
-
Tiempo: 50s.
-
Distancia del NH4OH(c)=20.
-
Distancia del HCl(c)=11.
5.- EJEMPLOS DE CALCULOS:
-
Calculamos la relación experimental promedio con la formula siguiente:
Re= (R1+R2+R3)/3.
-
Hallamos la distancia experimental promedio del hidróxido de amonio:
-
De (NH4OH(c)) = (D1+D2+D3) /3.
-
De (NH4OH(c)) = (20.8+23.5+20) /3.
-
De (NH4OH(c)) =21.433.
-
Hallamos la distancia experimental promedio del acido clorhídrico:
-
De (HCl(c)) = (D1+D2+D3)/3.
-
De (HCl(c))= (10.2+7.5+11)/3.
-
De (HCl(c))= 9.566.
-
Hallamos el tiempo experimental promedio de los gases:
-
Te= (T1+T2+T3) /3.
-
Te= (49+55+50) /3.
-
Te=51.333.
-
Calculamos la relación teórica:
1/2
Rt= D1 (NH4OH) = M2 (masa molecular del HCl)
D2 (HCl) M1 (masa molecular del NH4OH)
1/2
21.433 = 36.500
9.566 M1 (masa molecular del NH4OH)
M1 (masa molecular del NH4OH)= 7.260
6.-Discusión de resultados.-
Los resultados de los ejemplos tienen un porcentaje de error alto debido a k no se realizaron en el lugar ideal y porque tal vez no tuvimos el cuidado necesario, pero una de las principales causas es que no se utilizaron gases sino líquidos para el experimento lo que influyo el error, y para esto recomendamos que el trabajo se realice en un ambiente mas adecuado, con menos humedad y que se tengan los cuidados necesarios, como secar bien el tubo y si es posible trabajar con los gases directamente.
7.-Conclusiones y recomendaciones.-
a.- Conclusión.
La difusión de gases es un proceso que se realiza a diario en cualquier lugar. La de definimos como la tendencia de cualquier sustancia
b.-Recomendaciones
-Secar y tener limpio el tubo de difusión antes y después de cada experimento.
-Tener la seguridad de echar las 5 gotas pedidas.
-Tapar con fuerza los dos agujeros después de haber agregado las gotas.
-Tener una persona q sólo se dedique a anotar los tiempos y las medidas respectivas.
8.-Apéndice.-
| TRANSPORTE DE LOS GASES RESPIRATORIOS |
El O2 y el CO2 son transportados a través de los diferentes compartimentos por difusión. En la mayoría de los animales existe un sistema específico de transporte; el sistema circulatorio. O2 y CO2 son moléculas de tamaño similar; el transporte es similar.
FASES EN EL TRANSPORTE
ð Paso del aire o agua a la superficie respiratoria: movimientos respiratorios.
ð Difusión de gases a través del epitelio a la circulación sanguínea.
ð Transporte de los gases.
ð Difusión a los tejidos.
En mamíferos, la sangre contiene una parte de los gases en disolución. Otros animales tienen todos sus gases en disolución. La parte no diluida necesita un medio de transporte; los pigmentos respiratorios. En el hombre, 0.2 ml de O2/100 ml de sangre van diluídos, y 20 ml de O2/100 ml de sangre van en pigmentos.
PIGMENTOS RESPIRATORIOS
Hemoglobina. Contiene hierro. Es de color rojo. Está en todos los vertebrados y en algunos invertebrados, donde recibe el nombre de eritrocruorina.
Hemocianina. Tiene cobre. Es azul. Aparece en artrópodos y moluscos.
Clorocruorinas. Tienen hierro. Aparecen en 4 familias de anélidos poliquetos. Son verdes.
Hemeritrinas. Tienen hierro. Son violetas. Aparecen en : Gusanos sipuncúlidos, braquiópodos, priapúlidos, anélidos poliquetos (gen. Magelona)
AFINIDAD DE LA HEMOGLOBINA
Cuando la curva sigmoidea se desplaza a la derecha, la afinidad disminuye, y cuando se desplaza a la izquierda, la afinidad aumenta. Esto es así porque, cuando se desplaza a la derecha, se necesita una mayor presión parcial de O2 para que se sature. Esto tiene consecuencias:
Cuando la curva se desplaza a la izquierda:
- Se facilita la difusión del O2 de las superficies respiratorias a la sangre.
- En los tejidos, a la hemoglobina le cuesta mucho más liberar el O2 .
Cuando la curva se desplaza a la derecha:
- Se facilita la liberación de O2 a nivel de los tejidos.
TRANSPORTE DE CO2
Una forma de transporte es disuelto en plasma en forma de bicarbonato (HCO3-) Los H+ tienden a unirse a proteínas, de manera que no alteran el pH de la sangre.
Dentro del eritrocito, la reacción de formación de HCO3- es más rápida, ya que está catalizada por anhidrasa carbónica. Aquí, los H+ se unen a la hemoglobina desoxigenada.
El CO2 también puede transportarse dentro del eritrocito en forma de compuestos carbámicos. Para ello, el CO2 se une a la hemoglobina desoxigenada, favoreciéndose la descarga de O2 a nivel de los tejidos, ya que la afinidad de la hemoglobina por el O2 disminuye.
9.-Bibliografía
a.- Química
-Autor: Asociación educativa Pitágoras
-Edición: Primera
-Editorial: PERUANOS EDITORES E.I.R.L
-Año: 2004
-Pagina: 120-121
b.- www.apéndice.com.pe
c.- Química general
-Autor: Raymundo Chang
-Edición: Séptima
-Editorial: McGraw Hill Interamericana EDITORES S.A.
-Año:2002
-Pagina: 186-187
CUESTIONARIO
1. Deduzca la ecuación de la velocidad de una molécula que se desplaza linealmente.
2. ¿Qué factores determinan la diferencia entre Re y Rt?. Calcule el porcentaje de error relativo
3. Con los datos experimentales demuestre la Ley de Graham.
A las mismas condiciones la energía cinética es aproximadamente igual.
Sean los gases: “J” y “L”
EKJ = (mJ.VJ2)/2...............................(i)
EKL = (mL.VL2)/2.............................. (ii)
Igualando (i) y (ii):
1/2 . mJ.VJ2 = 1/2.mL.VL2
VJ2 = mL.....................(iii)
VL2 mJ
Pero: m = M
No
En (iii): VJ2 = ML/ No
VL2 MJ / No
Por lo tanto: VJ = ML/ No
VL MJ / No
Donde:
VJ : Velocidad de difusión del gas “J”
VL : Velocidad de difusión del gas “L”
MJ : Masa molecular del gas “J”
ML : Masa molecular del gas “L”
4. Escriba la ecuación química de la reacción que ocurre durante el experimento. Explique el fenómeno producido.
5. ¿Por qué el tubo de difusión debe estar limpio y completamente seco?
Como sabemos que la velocidad depende del espacio, en el experimento la lavar el tubo podrían quedarse algunas muestra de aguas al interior del tubo por lo cual el espacio puede alterarse y con este el tiempo, y por ultimo las ecuaciones cinéticas de los gases saldrían con diferencias en los experimentos
6. De las posibles fuentes de error experimental, explique Ud. ¿Cuál de ella tiene mayor incidencia?
Existen varias como la falta de limpieza del tubo, el error al calcular los tiempos, etc, pero la mayor seria la falta de precisión al echar las gotas por que debemos tener en cuenta que en los experimentos debemos echar la misma cantidad de gotas de los reactivos
7. ¿Cómo se podría mejorar el experimento?
Se mejoraría teniendo mas cuidado al manejar los instrumentos , secando bien el tubo y tapando bien los agujeros por donde se echa los reactivos para evitar el paso de otros gases.
4
Descargar
| Enviado por: | El remitente no desea revelar su nombre |
| Idioma: | castellano |
| País: | Perú |
