Física
Calor y temperatura
-
LA TEMPERATURA
-
¿Qué es?
-
¿Cómo se mide la temperatura?
-
Termopar
-
Termistor
-
Pirometros
-
Bandas de metal
-
Calibrado del termómetro. Escala Celsius de temperatura
-
Escalas de temperatura
-
Conversión de valores de temperaturas
-
Historia
-
en los gases encerrados a temperatura ambiente constante, el producto de la presión a que se someten por el volumen que adquieren permanece constante
-
la temperatura de ebullición disminuye con la presión
-
el de congelación de una disolución saturada de sal común en agua, que es la temperatura más baja que se podía obtener en un laboratorio, mezclando hielo o nieve y sal.
-
y la temperatura del cuerpo humano - una referencia demasiado ligada a la condición del hombre- .
-
CALOR
-
¿Qué es el calor?
-
¿Cómo se genera el calor?
-
La energía electromagnética (luz del Sol) calienta la Tierra. Esta es la primera fuente de toda la energía que llega a la Tierra y que luego se transforma en otros tipos de energía.
-
Los cuerpos emiten energía calorífica en forma de radiación en el infrarrojo.
-
Las reacciones químicas de combustión desprenden calor (exotérmicas), otras lo absorben (endotérmicas).
-
La electricidad circulando por una resistencia la calienta.
-
Un balón al chocar contra el suelo transforma su energía mecánica en calor al deformarse.
-
Nuestros cuerpos transforman la energía química de los alimentos en calor: para vivir necesitamos unas 2.100.000 calorías al día.
-
Las reacciones nucleares generan calor al desaparecer la masa.
-
Al producir un sonido hacemos vibrar las partículas de aire y esta energía se transmite en el aire: las ondas transportan energía.
-
¿Cómo se mide el calor?
-
Caloría
-
Capacidad calorífica
-
Transferencia de calor
-
Conducción
-
Convección
-
Radiación
-
CALOR Y TEMPERATURA. RELACIONES
-
EQUILIBRIO TÉRMICO
Todos sabemos intuitivamente de qué estamos hablando. Por medio del tacto notamos la temperatura al tocar un cuerpo ya que unas terminaciones nerviosas situadas en la piel se encargan de ello.
Los gatos poseen termo censores en la nariz que les permiten distinguir variaciones de 0.2º C.
Vamos estudiar el comportamiento de un gas para tratar de asociar esta sensación a una magnitud (algo que podemos medir) y para comprender qué cualidades de la materia manifiesta.
Toda la materia está formada por partículas en continua agitación: incluso los sólidos, que a simple vista parecen estar en reposo, la tienen.
En los sólidos las vibraciones son pequeñas. Si la energía de agitación es muy grande, se pueden llegar a romper los enlaces entre las moléculas y entre los átomos.
Las partículas se desenlazan y vibran libres, rotan, chocan entre si y contra las paredes del recipiente.
Este estado de la materia se llama gaseoso. El gas trata de ocupar todo el volumen del recipiente que lo contiene: trata de expandirse.
No todas las partículas se mueven en la misma dirección y con la misma velocidad. A cada estado concreto se le puede asignar una velocidad media.
En esta animación puedes ver las moléculas de un gas en continua agitación.
En un gas la temperatura es una magnitud (algo que podemos medir) que se relaciona con la medida de la velocidad media con que se mueven las partículas (por lo tanto con su energía cinética o nivel de agitación).
La temperatura no depende del número de partículas que se mueven sino de su velocidad media: a mayor temperatura mayor velocidad media. No depende por tanto de la masa total del cuerpo: si dividimos un cuerpo con una temperatura "T" en dos partes desiguales las dos tienen la misma temperatura.
La temperatura es una magnitud que refleja el nivel térmico de un cuerpo (su capacidad para ceder energía calorífica) y el calor es la energía que pierde o gana en ciertos procesos (es un flujo de energía entre dos cuerpos que están a diferentes temperaturas).
Nivel térmico es el nivel de agitación. Comparando los niveles térmicos sabemos hacia donde fluye el calor.
La temperatura refleja el nivel térmico de un cuerpo e indica el sentido en que fluye el calor.
Nuestro tacto detecta la temperatura, pero carece de la capacidad de medirla con rigor.
Realizando esta experiencia lo comprenderás:
Introduce una mano en un recipiente frío y la otra en uno caliente, y luego las dos manos juntas en otro recipiente con agua templada.
La primera mano la encontrará caliente y la otra fría.
Del cuerpo que está a mayor temperatura decimos que "está más caliente" y a veces, erróneamente, se dice "que tiene más calor". Los cuerpos no tienen calor, tienen energía interna y tienen temperatura. Reservamos el término "calor" para la energía que se transfiere de un cuerpo a otro. Esta energía es fácil de medir, pero la energía total que tiene el cuerpo no.
Si un cuerpo recibe energía calorífica aumenta la agitación de las partículas que lo forman (átomos, moléculas o iones) y se pueden producir también cambios en la materia: dilatación, cambios de color (piensa en una barra de metal al calentarla), variación de su resistencia a la conducción, etc. Estos cambios se pueden utilizar para hacer una escala de temperatura.
Al poner en contacto dos sustancias la agitación de las partículas de una se transmite, mediante choques, a las partículas de la otra hasta que se igualan sus velocidades. Las partículas de la sustancia más caliente son más rápidas y poseen más energía. En cada impacto ceden parte de la energía a las partículas más lentas con las que entran en contacto. Las partículas de la sustancia que está a mayor T se frenan un poco, pero al mismo tiempo hacen que las más lentas aceleren.
Finalmente las partículas de las dos sustancias alcanzan la misma velocidad media y por lo tanto la misma temperatura: se alcanza el "equilibrio térmico".
Para diseñar un instrumento que mida la temperatura debemos escoger una cualidad de la materia que sea fácilmente observable, que varíe de manera importante con la agitación de sus partículas, que sea fácil de medir y que nos permita relacionar su variación con la agitación que tiene el cuerpo.
La cualidad elegida en los termómetros de mercurio es la dilatación, pero existen otros tipos de termómetros basados en otras cualidades.
Se utiliza el mercurio para construir termómetros porque es un metal que es líquido entre -20 ºC y 100ºC y porque se dilata mucho. Encerramos el metal dentro de un tubo fino (capilar) para que al dilatarse un poco avance mucho por el tubo (cuanto más fino sea el tubo más centímetros avanza). Midiendo longitudes de la columna podemos establecer una relación entre la dilatación y el nivel de agitación de la sustancia a medir.

¡Medimos la temperatura midiendo una longitud!
Se pueden tomar como base para medir las temperaturas otras propiedades que cambien con ella como el color, la resistencia eléctrica, etc. Aparatos basados en las anteriores propiedades son el pirómetro óptico, el termopar....
Este termómetro es el más usado, aunque no el más preciso, porque el mercurio a los - 40 0C se congela restringiendo el rango o intervalo en que se puede usar.
Por este motivo hay otros métodos de medición que algunas veces resultan complicados en su estudio pero en la práctica son de gran ayuda, como los siguientes:
Se basa en un voltaje eléctrico producido por la unión de conductores diferentes y que cambia con la temperatura, este voltaje se usa como medida indirecta de la temperatura.
Este método se obtiene gracias a la propiedad de variación de la resistencia eléctrica con la temperatura.
Se usa en los casos donde las temperaturas a medir son altas. La medición se logra por el registro de la energía radiante (radiación electromagnética; por ejemplo emisión de infrarrojo) que desprende un cuerpo caliente.
Cuando dos tiras de metal delgadas, unidas en uno de sus extremos, se dilatan a diferente velocidad cuando cambia la temperatura. Estas tiras se utilizan en los radiadores de los automóviles, y en los sistemas de calentamiento y aire acondicionado.
Celsius, eligió como cero de temperatura para su escala la temperatura del hielo en contacto con agua. Las temperaturas inferiores, por lo tanto, serán negativas.
Para marcar ese punto en el termómetro, lo introducimos en una mezcla de agua y hielo y esperamos hasta que se estabilice la posición del mercurio de la columna. Marcamos ese punto en el vidrio (es el extremo de la columna de mercurio en ese momento) como punto 0.
|
|
|
Calentamos agua en un Erlenmeyer cerrado con un tapón bihoradado. Por un agujero del tapón sale un tubo y por él vapor, por el otro introducimos el termómetro. Se inserta hasta que el bulbo quede en un punto próximo a la superficie del agua.
La columna de mercurio sube pero cuando el agua empieza a hervir se para y no sube más. Marcamos el vidrio en ese punto como punto 100. Si la presión no es 1 atm. La temperatura de ebullición no será 100 ºC.
|
|
|
Dividimos la longitud del vidrio entre 0 y 100 en 100 partes iguales. A cada división le corresponde 1 grado centígrado.
Con el termómetro de mercurio medimos la temperatura del aire. Este es el dato climatológico más conocido. El termómetro recibe el calor trasmitido por conducción del aire que lo rodea.
¡No debemos exponer el termómetro al Sol para medir la temperatura del aire!
No debemos exponer un bulbo del termómetro a los rayos del Sol porque, en este caso, además del calor que recibe del aire recibe la radiación solar y recibe más cuanto mayor sea el bulbo del termómetro.
No sería correcta la lectura puesto que dos termómetros correctamente calibrados colocados en el mismo sitio y expuestos al Sol no marcan lo mismo: el que tenga el bulbo más grande marca una temperatura mayor.
A lo largo de los años se establecieron diferentes escalas.
En 1967 se adoptó la temperatura del punto triple del agua como único punto fijo para la definición de la escala absoluta de temperaturas y la separación centígrada de la escala Celsius. El nivel cero quedaba a -273,15 K del punto triple y se definía como el cero absoluto o 0 K. Esta escala sustituyó a la escala centígrada o Celsius al definir el cero como el punto más bajo posible e inalcanzable en la práctica.
A la temperatura del cero absoluto no hay movimiento y desde él no se puede sacar calor. En ese estado todo el movimiento atómico y molecular se detiene, es la temperatura más baja posible. Todos los objetos tienen una temperatura más alta que el cero absoluto y por lo tanto emiten energía térmica o calor. El espacio interestelar casi vacío tiene temperatura ligeramente superior al 0 K.
En este esquema comparativo puedes ver las escalas más importantes:
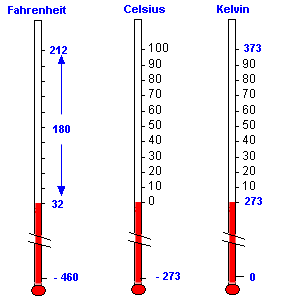
La escala Celsius y la escala Kelvin tienen una transformación muy sencilla:
Grados K=273.15 + grados C
En la transformación de grados centígrados a grados Fahrenheit debes tener en cuenta que cada grado centígrado vale 1,8 ºF (0 - 100 en la escala centígrada equivale a 32 - 210 en la escala Fahrenheit). Por lo tanto debes multiplicar los grados centígrados por 1,8 que equivale a 9/5. Como el cero Celsius corresponde al 32 Fahrenheit debes sumar 32:
GradosF= (9/5)*gradosC+32
Para la transformación inversa se despeja y queda:
GradosC= (5/9)*(grados F-32)
La temperatura de los cuerpos es un concepto que el hombre primitivo (precientífico) captó a través de sus sentidos.
Si tocamos dos piedras iguales, una a la sombra y otra calentada por el sol (o por el fuego de una hoguera) las encontramos diferentes. Tienen algo distinto que detecta nuestro tacto, la temperatura.
La temperatura no depende de si la piedra se desplaza o de si está quieta y tampoco varía si se fragmenta.
Las primeras valoraciones de la temperatura dadas a través del tacto son simples y poco matizadas. De una sustancia sólo podemos decir que esta caliente, tibia (caliente como el cuerpo humano), templada (a la temperatura del ambiente), fría y muy fría.
Con el diseño de aparatos se pudieron establecer escalas para una valoración más precisa de la temperatura.
El primer termómetro (vocablo que proviene del griego thermes y metron, medida del calor) se atribuye a Galileo que diseñó uno en 1592 con un bulbo de vidrio del tamaño de un puño y abierto a la atmósfera a través de un tubo delgado.
Para evaluar la temperatura ambiente, calentaba con la mano el bulbo e introducía parte del tubo (boca abajo) en un recipiente con agua coloreada. El aire circundante, más frío que la mano, enfriaba el aire encerrado en el bulbo y el agua coloreada ascendía por el tubo.
La distancia entre el nivel del líquido en el tubo y en el recipiente se relacionaba con la diferencia entre la temperatura del cuerpo humano y la del aire.
Si se enfriaba la habitación el aire se contraía y el nivel del agua ascendía en el tubo. Si se calentaba el aire en el tubo, se dilataba y empujaba el agua hacia abajo.
Las variaciones de presión atmosférica que soporta el agua pueden hacer variar el nivel del líquido sin que varíe la temperatura. Debido a este factor las medidas de temperatura obtenidas por el método de Galileo tienen errores. En 1644 Torricelli estudió la presión y construyó el primer barómetro para medirla.
En 1641, el Duque de Toscana, construye el termómetro de bulbo de alcohol con capilar sellado, como los que usamos actualmente. Para la construcción de estos aparatos fue fundamental el avance de la tecnología en el trabajo del vidrio.
A mediados del XVII, Robert Boyle descubrió las dos primeras leyes que manejan el concepto de temperatura:
Posteriormente se descubrió, pese a la engañosa evidencia de nuestros sentidos, que todos los cuerpos expuestos a las mismas condiciones de calor o de frío alcanzan la misma temperatura (ley del equilibrio térmico). Al descubrir esta ley se introduce por primera vez una diferencia clara entre calor y temperatura. Todavía hoy y para mucha gente estos términos no están muy claros.
Los termómetros tuvieron sus primeras aplicaciones prácticas en Meteorología, en Agricultura (estudio de la incubación de huevos), en Medicina (fiebres), etc., pero las escalas eran arbitrarias: "estaba tan caliente como el doble del día más caliente del verano" o tan fría como "el día más frío del invierno".
Antes de la aparición de los termómetros de mercurio se construyeron termómetros de alcohol como los de Amontons y Reamur.
En 1717 Fahrenheit, un germano-holandés (nació en Dancing y emigró a Amsterdam), fabricante de instrumentos técnicos, construyó e introdujo el termómetro de mercurio con bulbo (usado todavía hoy) y tomó como puntos fijos:
Dividió la distancia que recorría el mercurio en el capilar entre estos dos estados en 96 partes iguales.
Newton había sugerido 12 partes iguales entre la congelación del agua y la temperatura del cuerpo humano. El número 96 viene de la escala de 12 grados, usada en Italia en el S. XVII (12*8=96).
Aunque la temperatura de la mejor proporción de hielo y sal es alrededor de -20 ºC Fahrenheit, finalmente, ajustó la escala para que el punto de congelación del agua (0 ºC en la escala Celsius) fuera de 32 ºF y la temperatura de ebullición del agua de 212 ºF.
La escala Fahrenheit, que se usa todavía en los países anglosajones, no tenía valores negativos (no se podían lograr en esa época temperaturas por debajo de cero grados) y era bastante precisa por la dilatación casi uniforme del mercurio en ese intervalo de temperaturas.
En la Inglaterra victoriana de Guillermo Brown una fiebre que provocara 100 grados de temperatura libraba al niño de ir a clase ese día.
Con este termómetro de precisión Farenheit consiguió medir la variación de la temperatura de ebullición del agua con la presión del aire ambiente y comprobó que todos los líquidos tiene un punto de ebullición característico.
En 1740, Celsius, científico sueco de Upsala, propuso los puntos de fusión y ebullición del agua al nivel del mar (P=1 atm) como puntos fijos y una división de la escala en 100 partes (grados).
Como en Suecia interesaba más medir el grado de frío que el de calor le asignó el 100 al punto de fusión del hielo y el 0 al del vapor del agua en la ebullición. Más tarde el botánico y explorador Linneo invirtió el orden y le asignó el 0 al punto de congelación del agua.
Esta escala, que se llamó centígrada por contraposición a la mayoría de las demás graduaciones, que eran de 60 grados según la tradición astronómica, ha perdurado hasta época reciente (1967) y se proyectó en el Sistema métrico decimal (posterior a la Revolución Francesa).
La escala Kelvin tiene como referencia la temperatura más baja del cosmos.
Para definir la escala absoluta o Kelvin es necesario recordar lo que es el punto triple. El llamado punto triple es un punto muy próximo a 0 ºC en el que el agua, el hielo y el valor de agua están en equilibrio.
En 1967 se adoptó la temperatura del punto triple del agua como único punto fijo para la definición de la escala absoluta de temperaturas y se conservó la separación centígrada de la escala Celsius. El nivel cero queda a -273,15 K del punto triple y se define como cero absolutos o 0 K. En esta escala no existen temperaturas negativas. Esta escala sustituye a la escala centígrada o Celsius.
A la temperatura del cero absoluto no existe ningún tipo de movimiento y no se puede sacar calor. Es la temperatura más baja posible y todo el movimiento atómico y molecular se detiene. Todos los objetos tienen una temperatura más alta que el cero absoluto y por lo tanto pueden emitir energía térmica o calor.
Paralelamente al estudio de los conceptos de temperatura y de calor se empezaron a desarrollar aplicaciones técnicas derivadas de la manipulación de la energía térmica.
A finales del s. XVII se empezó a utilizar el vapor de agua para mover las bombas de achique de las minas de carbón en Inglaterra. Las primeras máquinas fueron la bomba de Savery (1698) y la de Newcomen (1711). La máquina de Savery consistía en un cilindro conectado mediante una cañería a la fuente de agua que se deseaba bombear, el cilindro se llenaba de vapor de agua, se cerraba la llave de ingreso y luego se enfriaba. Cuando el vapor se condensaba se producía un vacío que permitía el ascenso del agua.
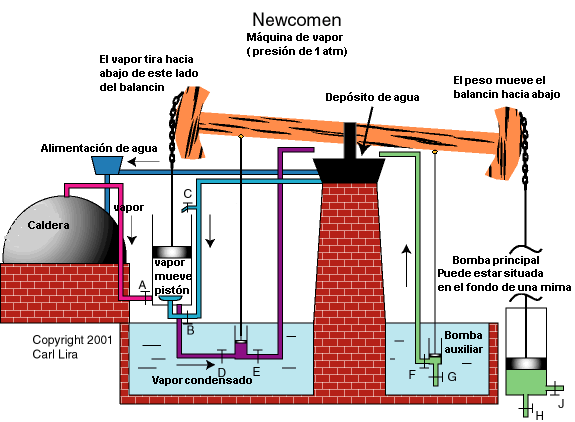
En la máquina de Newcomen el vapor a presión atmosférica (sin recalentar) procedente de una caldera (alambique de cobre de cervecería) se metía en un cilindro y elevaba un émbolo.
El émbolo estaba conectado a un balancín. El balancín al quedar libre por el peso de las cuerdas y de los contrapesos accionaba la bomba de achique en la mina en un sentido, luego se cerraba la entrada de vapor y se inyectaba agua fría que ocasionaba un gran vacío en el cilindro. El pistón se movía y arrastraba el balancín en el otro sentido, con lo cual se elevaba el pistón de la bomba. El ciclo se repetía indefinidamente.
Esta conversión de energía térmica en energía mecánica, que daba 4 Kw. con un rendimiento del 1%, fue el fundamento de la Revolución Industrial y dio origen a una nueva ciencia: la Termodinámica, que estudia la transformación de calor (termo) en trabajo (dinámica).
Durante el siglo XVIII se asentaron las bases para utilizar las máquinas de vapor para mover maquinaria industrial, para el transporte marítimo (barcos) y terrestre (locomotoras).... En 1769 Watt ideó la separación entre el expansor y el condensador y a partir de entonces empezó la fabricación a nivel industrial.
En 1765, el profesor de química escocés Joseph Black (Watt fue ayudante suyo) realizó un gran número de ensayos calorimétricos, distinguiendo claramente entre calor (cantidad de energía) y temperatura (nivel térmico). Introdujo los conceptos de calor específico y de calor latente de cambio de estado.
Uno de los experimentos de Black consistía en echar un bloque de hierro caliente en un baño de hielo y agua y observar que la temperatura no variaba. Desgraciadamente, sus experimentos eran a presión constante cuando se trataba de líquidos, y a volumen constante cuando eran gases, y el trabajo intercambiado por el sistema con el exterior era siempre despreciable, dando origen a la creencia errónea de que el calor se conservaba en los procesos térmicos: famosa y errónea teoría del calórico.
En 1798, B. Thompson (conde Rumford) rebatió la teoría del calórico de Black diciendo que se podía generar continuamente calor por fricción, en contra de lo afirmado por dicha teoría. Hoy día suele mostrarse esta teoría del calórico (que fue asumida por grandes científicos como Lavoisier, Fourier, Laplace, Poisson y que llegó a utilizar Carnot para descubrir el "Segundo Principio de la Termodinámica") como el ejemplo más notorio que a veces una teoría inicial equivocada puede conducir al final a resultados correctos que obligan a revisarla. ¡Así avanzan las CIENCIAS!
No fue hasta 1842, con los concluyentes experimentos de Mayer y Joule, cuando se desechó la teoría de calórico y se estableció que el calor es una forma de energía.
Mayer y Joule establecen una correspondencia entre la energía mecánica y el calor producido por el movimiento de unas paletas dentro de agua cuando son accionadas por unas pesas que disminuían su energía potencial.
Su equivalencia: 1 caloría=4,18 Julios
Durante muchos años se creyó que el calor era un componente que impregnaba la materia y que los cuerpos absorbían o desprendían según los casos.
Lo que ves a la derecha es una manifestación del calor, es una llama, pero no es el calor.
El calor es un concepto y por lo tanto no se ve. Si puedes percibir los efectos del calor.
Rumford, taladrando tubos de metal para construir cañones, se dio cuenta de que cuanto más roma estaba la broca más calor se desprendía. Si el calor estuviera retenido en el cuerpo impregnándolo saldría más cuanto más se desmenuzara la materia en virutas...pero no era así, era justamente al revés. (Benjamín Thomson - Conde Rumford)
¡El calor se generaba al rozar la broca con el metal! ¡La energía cinética de la broca se transformaba en calor!
El calor es por lo tanto una forma de energía. Es la "energía calorífica". Un inglés llamado J.P. Joule halló su equivalencia con las unidades del trabajo.
El Universo está hecho de materia y energía. La materia está compuesta de átomos y moléculas (que son grupos de átomos) y la energía hace que los átomos y las moléculas estén en constante movimiento: rotando alrededor de si mismas, vibrando o chocando unas con otras. Cuando la materia desaparece (a veces esto ocurre espontáneamente en las sustancias radiactivas) se transforma en energía (E=mc2)
El movimiento de los átomos y moléculas está relacionado con el calor o energía térmica. Al calentar una sustancia aumenta la velocidad de las partículas que la forman.
La cantidad total y absoluta de energía que tiene un cuerpo, que es la que podría teóricamente ceder, es muy difícil de precisar.
Nos referimos al calor como a esa energía que intercambian los cuerpos (energía de tránsito) y que podemos medir fácilmente.
El calor es una energía que fluye de los cuerpos que se encuentran a mayor temperatura a los de menor temperatura. Para que fluya se requiere una diferencia de temperatura. El cuerpo que recibe calor aumenta su temperatura, el que cede calor disminuye su temperatura. Resulta evidente que los dos conceptos, calor y temperatura, están relacionados.
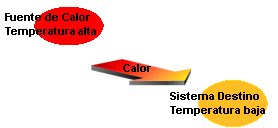
Los cuerpos radian unos hacia otros pero el balance total del intercambio es favorable a uno y desfavorable al otro hasta que se alcanza el equilibrio térmico.
El calor es una energía de tránsito, sólo tiene sentido hablar de variación de calor mientras la energía fluye de un cuerpo a otro.
Es una energía degradada ya que es imposible recuperar toda la energía mecánica que se invirtió en producirlo. Se recupera energía mecánica haciéndolo fluir en las máquinas térmicas del foco caliente al frío y retirando parte de esa energía en forma de energía mecánica (movimiento) pero una parte importante del calor debemos arrojarla al entorno en el foco frío.
Los rendimientos de las máquinas se calculan por la relación de temperaturas entre las que funcionan y es imposible un rendimiento del 100%
R= (T1-T2)/ T1
La energía puede presentarse de muy diferentes formas y puede cambiar de una forma a otra.
Ya vimos la experiencia de Rumford en la que por rozamiento la broca transformaba energía cinética en energía calorífica. Pero existen otras transformaciones de energía.....
El agua es importantísima en nuestra vida. Se ha utilizado para establecer la escala de Celsius de temperaturas y tiene una excepcional cualidad que hizo que se eligiera para definir el patrón de la energía calorífica: el agua es una de las sustancias que, aunque reciba mucha energía calorífica, incrementa muy poco su temperatura.
Esta cualidad del agua es la responsable del clima benigno (poco oscilante entre el día y la noche) en las proximidades del mar para una misma latitud terrestre.
La capacidad del agua de "encajar" los impactos de calor "sin casi inmutarse" incrementando poco su temperatura se representa mediante una magnitud llamada "calor específico" (Ce): calor que necesita 1 g de sustancia para aumentar 1 grado su temperatura.
En consecuencia, el calor específico del agua es 1 cal /g. grado.
Se llama caloría " la cantidad de calor necesaria para que 1g de agua aumente 1º su temperatura" (más exactamente para pasar de 14,5 º a 15,5º)
Una vez demostrado que el calor es una forma de energía se halló su equivalencia con otras unidades que surgieron del estudio de la energía mecánica. Hoy se utiliza siempre el S.I. y usamos como unidad de trabajo y de energía el fisicaInteractiva/Calor/historia/historia.htm">julio (1 caloría=4,18 Julios).
En el S.I. el Ce (agua)=4180 J/Kg. ºK.
Cada sustancia tiene un calor específico característico, casi siempre mucho menor que el del agua.
| calores específicos | |
| Sustancia | Cal /g ºC |
| Aluminio | 0,212 |
| Cobre | 0,093 |
| Hierro | 0,113 |
| Mercurio | 0,033 |
| Plata | 0,060 |
| Latón | 0,094 |
| Agua de mar | 0,945 |
| Vidrio | 0,199 |
| Arena | 0,20 |
| Hielo | 0,55 |
| Agua | 1,00 |
| Alcohol | 0,58 |
| Lana de vidrio | 0,00009 |
| Aire | 0,0000053 |
Pero la cantidad de calor que puede acumular o perder una masa de agua depende, además de su calor específico, de la masa de la sustancia. El producto de la masa por el calor específico se llama "capacidad calorífica".
Cuanta más capacidad calorífica tenga un cuerpo menos incremente su temperatura para un mismo aporte de calor. Es como la capacidad que tiene la sustancia para "encajar" el calor.
El calor necesario para un mismo incremento de temperatura de una cierta sustancia depende de su masa: cuanta más masa, más calor se requiere.
Uniendo todos los factores anteriores obtenemos la fórmula que nos da el calor cedido o absorbido por un cuerpo cuando varía su temperatura:
D Q=m cuerpo· Ce (cuerpo). (TF- TI)
Para medirlo necesitamos conocer el comportamiento de la sustancia frente al calor, es decir su Ce, su masa y el indicativo de su nivel térmico (su temperatura) antes y después de recibir o perder calor.
A veces la sustancia recibe energía (calor) y no incrementa su temperatura. Es lo que ocurre en los cambios de estado. Un caso concreto lo tenemos en la fusión del hielo. Si suministramos calor a una mezcla formada por hielo fundido y hielo sin fundir el calor se emplea en fundir más hielo y la temperatura del agua no se incrementa.
La fórmula para hallar la cantidad de hielo que se funde con una determinada cantidad de calor es:
DQ=m· L fusión
Donde L fusión es el calor latente de fusión expresado en J/Kg., una cantidad característica de cada sustancia. Indica la energía que debemos aportar para separa la moléculas al pasar de sólido a líquido.
En física, proceso por el que se intercambia energía en forma de calor entre distintos cuerpos, o entre diferentes partes de un mismo cuerpo que están a distinta temperatura. El calor se transfiere mediante convección, radiación o conducción. Aunque estos tres procesos pueden tener lugar simultáneamente, puede ocurrir que uno de los mecanismos predomine sobre los otros dos. Por ejemplo, el calor se transmite a través de la pared de una casa fundamentalmente por conducción, el agua de una cacerola situada sobre un quemador de gas se calienta en gran medida por convección, y la Tierra recibe calor del Sol casi exclusivamente por radiación.
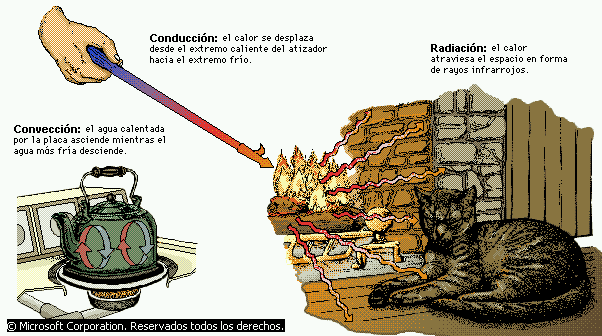
El calor puede transferirse de tres formas: por conducción, por convección y por radiación. La conducción es la transferencia de calor a través de un objeto sólido: es lo que hace que el asa de un atizador se caliente aunque sólo la punta esté en el fuego. La convección transfiere calor por el intercambio de moléculas frías y calientes: es la causa de que el agua de una tetera se caliente uniformemente aunque sólo su parte inferior esté en contacto con la llama. La radiación es la transferencia de calor por radiación electromagnética (generalmente infrarroja): es el principal mecanismo por el que un fuego calienta la habitación.
En los sólidos, la única forma de transferencia de calor es la conducción. Si se calienta un extremo de una varilla metálica, de forma que aumente su temperatura, el calor se transmite hasta el extremo más frío por conducción. No se comprende en su totalidad el mecanismo exacto de la conducción de calor en los sólidos, pero se cree que se debe, en parte, al movimiento de los electrones libres que transportan energía cuando existe una diferencia de temperatura. Esta teoría explica por qué los buenos conductores eléctricos también tienden a ser buenos conductores del calor. En 1822, el matemático francés Joseph Fourier dio una expresión matemática precisa que hoy se conoce como ley de Fourier de la conducción del calor. Esta ley afirma que la velocidad de conducción de calor a través de un cuerpo por unidad de sección transversal es proporcional al gradiente de temperatura que existe en el cuerpo (con el signo cambiado).
El factor de proporcionalidad se denomina conductividad térmica del material. Los materiales como el oro, la plata o el cobre tienen conductividades térmicas elevadas y conducen bien el calor, mientras que materiales como el vidrio o el amianto tienen conductividades cientos e incluso miles de veces menores; conducen muy mal el calor, y se conocen como aislantes. En ingeniería resulta necesario conocer la velocidad de conducción del calor a través de un sólido en el que existe una diferencia de temperatura conocida. Para averiguarlo se requieren técnicas matemáticas muy complejas, sobre todo si el proceso varía con el tiempo; en este caso, se habla de conducción térmica transitoria. Con la ayuda de ordenadores (computadoras) analógicos y digitales, estos problemas pueden resolverse en la actualidad incluso para cuerpos de geometría complicada.
Si existe una diferencia de temperatura en el interior de un líquido o un gas, es casi seguro que se producirá un movimiento del fluido. Este movimiento transfiere calor de una parte del fluido a otra por un proceso llamado convección. El movimiento del fluido puede ser natural o forzado. Si se calienta un líquido o un gas, su densidad (masa por unidad de volumen) suele disminuir. Si el líquido o gas se encuentra en el campo gravitatorio, el fluido más caliente y menos denso asciende, mientras que el fluido más frío y más denso desciende. Este tipo de movimiento, debido exclusivamente a la no uniformidad de la temperatura del fluido, se denomina convección natural. La convección forzada se logra sometiendo el fluido a un gradiente de presiones, con lo que se fuerza su movimiento de acuerdo a las leyes de la mecánica de fluidos.
Supongamos, por ejemplo, que calentamos desde abajo una cacerola llena de agua. El líquido más próximo al fondo se calienta por el calor que se ha transmitido por conducción a través de la cacerola. Al expandirse, su densidad disminuye y como resultado de ello el agua caliente asciende y parte del fluido más frío baja hacia el fondo, con lo que se inicia un movimiento de circulación. El líquido más frío vuelve a calentarse por conducción, mientras que el líquido más caliente situado arriba pierde parte de su calor por radiación y lo cede al aire situado por encima. De forma similar, en una cámara vertical llena de gas, como la cámara de aire situada entre los dos paneles de una ventana con doble vidrio, el aire situado junto al panel exterior —que está más frío— desciende, mientras que al aire cercano al panel interior —más caliente— asciende, lo que produce un movimiento de circulación.
El calentamiento de una habitación mediante un radiador no depende tanto de la radiación como de las corrientes naturales de convección, que hacen que el aire caliente suba hacia el techo y el aire frío del resto de la habitación se dirija hacia el radiador. Debido a que el aire caliente tiende a subir y el aire frío a bajar, los radiadores deben colocarse cerca del suelo (y los aparatos de aire acondicionado cerca del techo) para que la eficiencia sea máxima. De la misma forma, la convección natural es responsable de la ascensión del agua caliente y el vapor en las calderas de convección natural, y del tiro de las chimeneas. La convección también determina el movimiento de las grandes masas de aire sobre la superficie terrestre, la acción de los vientos, la formación de nubes, las corrientes oceánicas y la transferencia de calor desde el interior del Sol hasta su superficie.
La radiación presenta una diferencia fundamental respecto a la conducción y la convección: las sustancias que intercambian calor no tienen que estar en contacto, sino que pueden estar separadas por un vacío. La radiación es un término que se aplica genéricamente a toda clase de fenómenos relacionados con ondas electromagnéticas. Algunos fenómenos de la radiación pueden describirse mediante la teoría de ondas, pero la única explicación general satisfactoria de la radiación electromagnética es la teoría cuántica. En 1905, Albert Einstein sugirió que la radiación presenta a veces un comportamiento cuantizado: en el efecto fotoeléctrico, la radiación se comporta como minúsculos proyectiles llamados fotones y no como ondas. La naturaleza cuántica de la energía radiante se había postulado antes de la aparición del artículo de Einstein, y en 1900 el físico alemán Max Planck empleó la teoría cuántica y el formalismo matemático de la mecánica estadística para derivar una ley fundamental de la radiación. La expresión matemática de esta ley, llamada distribución de Planck, relaciona la intensidad de la energía radiante que emite un cuerpo en una longitud de onda determinada con la temperatura del cuerpo. Para cada temperatura y cada longitud de onda existe un máximo de energía radiante. Sólo un cuerpo ideal (cuerpo negro) emite radiación ajustándose exactamente a la ley de Planck. Los cuerpos reales emiten con una intensidad algo menor.
La contribución de todas las longitudes de onda a la energía radiante emitida se denomina poder emisor del cuerpo, y corresponde a la cantidad de energía emitida por unidad de superficie del cuerpo y por unidad de tiempo. Como puede demostrarse a partir de la ley de Planck, el poder emisor de una superficie es proporcional a la cuarta potencia de su temperatura absoluta. El factor de proporcionalidad se denomina constante de Stefan-Boltzmann en honor a dos físicos austriacos, Joseph Stefan y Ludwig Boltzmann que, en 1879 y 1884 respectivamente, descubrieron esta proporcionalidad entre el poder emisor y la temperatura. Según la ley de Planck, todas las sustancias emiten energía radiante sólo por tener una temperatura superior al cero absoluto. Cuanto mayor es la temperatura, mayor es la cantidad de energía emitida. Además de emitir radiación, todas las sustancias son capaces de absorberla. Por eso, aunque un cubito de hielo emite energía radiante de forma continua, se funde si se ilumina con una lámpara incandescente porque absorbe una cantidad de calor mayor de la que emite.
Las superficies opacas pueden absorber o reflejar la radiación incidente. Generalmente, las superficies mates y rugosas absorben más calor que las superficies brillantes y pulidas, y las superficies brillantes reflejan más energía radiante que las superficies mates. Además, las sustancias que absorben mucha radiación también son buenos emisores; las que reflejan mucha radiación y absorben poco son malos emisores. Por eso, los utensilios de cocina suelen tener fondos mates para una buena absorción y paredes pulidas para una emisión mínima, con lo que maximizan la transferencia total de calor al contenido de la cazuela.
Algunas sustancias, entre ellas muchos gases y el vidrio, son capaces de transmitir grandes cantidades de radiación. Se observa experimentalmente que las propiedades de absorción, reflexión y transmisión de una sustancia dependen de la longitud de onda de la radiación incidente. El vidrio, por ejemplo, transmite grandes cantidades de radiación ultravioleta, de baja longitud de onda, pero es un mal transmisor de los rayos infrarrojos, de alta longitud de onda. Una consecuencia de la distribución de Planck es que la longitud de onda a la que un cuerpo emite la cantidad máxima de energía radiante disminuye con la temperatura. La ley de desplazamiento de Wien, llamada así en honor al físico alemán Wilhelm Wien, es una expresión matemática de esta observación, y afirma que la longitud de onda que corresponde a la máxima energía, multiplicada por la temperatura absoluta del cuerpo, es igual a una constante, 2.878 micrómetros-Kelvin. Este hecho, junto con las propiedades de transmisión del vidrio antes mencionadas, explica el calentamiento de los invernaderos. La energía radiante del Sol, máxima en las longitudes de onda visibles, se transmite a través del vidrio y entra en el invernadero. En cambio, la energía emitida por los cuerpos del interior del invernadero, predominantemente de longitudes de ondas mayores, correspondientes al infrarrojo, no se transmiten al exterior a través del vidrio. Así, aunque la temperatura del aire en el exterior del invernadero sea baja, la temperatura que hay dentro es mucho más alta porque se produce una considerable transferencia de calor neta hacia su interior.
Además de los procesos de transmisión de calor que aumentan o disminuyen las temperaturas de los cuerpos afectados, la transmisión de calor también puede producir cambios de fase, como la fusión del hielo o la ebullición del agua. En ingeniería, los procesos de transferencia de calor suelen diseñarse de forma que aprovechen estos fenómenos. Por ejemplo, las cápsulas espaciales que regresan a la atmósfera de la Tierra a velocidades muy altas están dotadas de un escudo térmico que se funde de forma controlada en un proceso llamado ablación para impedir un sobrecalentamiento del interior de la cápsula. La mayoría del calor producido por el rozamiento con la atmósfera se emplea en fundir el escudo térmico y no en aumentar la temperatura.
D Q=m cuerpo· Ce (cuerpo). (TF- TI)
De la aplicación de la fórmula se deducen algunas relaciones:
Para dos masas iguales de una misma sustancia sometida sometidas a un aporte de calor Q y 2Q respectivamente,
¿Qué pasa con el incremento de T?


Si suministramos una cantidad de calor Q a dos masas de la misma sustancia, una doble de la otra, m y m/2,


Para dos masas iguales una de aceite y otra de agua sometidas al mismo aporte de calor, Q,
¿Qué pasa con el incremento de T?
¿Las masas de aceite y agua tienen igual volumen?


Si en el universo se alcanzara el equilibrio y existiera en todos los lugares la misma temperatura eso supondría la muerte, la quietud, la falta de cambio.

Todos los cuerpos tienen una energía llamada energía interna. La cantidad de energía interna de un cuerpo es muy difícil de establecer ya que las partículas que forman un cuerpo tienen energías muy variadas. Tienen energías de tipo eléctrico, de rotación, de traslación y vibración debido a los movimientos que poseen, energías de enlace (que pueden dar posibles reacciones químicas) e incluso energía al desaparecer la materia y transformarse en energía DE=mc2....
Lo más fácil de medir es la variación de energía en un proceso de transformación concreto y si el proceso es sólo físico mucho mejor. (Ejemplos: calentamiento, cambios de estado...).
Al poner en contacto dos cuerpos a distinta temperatura, el de mayor temperatura cede parte de su energía al de menos temperatura hasta que sus temperaturas se igualan. Se alcanza así lo que llamamos "equilibrio térmico".
La energía calorífica (calor) no pasa del cuerpo que tiene más energía al que tiene menos sino del que tiene mayor temperatura al que la tiene menor.
Con el siguiente ejemplo aclaramos la anterior afirmación:
Los mares (los océanos están intercomunicados) pueden ceder mucha más energía calorífica que mi cuerpo. El mar es capaz de fundir un iceberg y sus aguas apenas se enfrían unos grados. Yo, con el calor que puedo desprender en todos los días de mi vida (parte de las 2.100.000 calorías que consumo al día) fundiría muy pocas toneladas de iceberg.
Puede ceder mucho más calor el mar que mi cuerpo.
Pero si me sumerjo en el agua de mar el calor pasa de mi cuerpo al mar.
El calor fluye desde los cuerpos que están a más temperatura a los que están a temperatura menor.

Vamos a comprobarlo
Calentamos en un tubo de ensayo 25 ml H2O (agua) hasta una temperatura alta. Lo introducimos centrado en un vaso de precipitados mas grande que contiene 100 ml de agua. Medimos las temperaturas de los dos a intervalos de un minuto.
Agitamos el tubo de ensayo para homogeneizar la temperatura dentro y fuera y mantenemos la sonda externa alejada del tubo de ensayo.
Registramos los datos, los anotamos en una tabla y registramos gráficamente las temperaturas de cada uno frente al tiempo.
En nuestro caso el registro lo hizo el aparato electrónico y la gráfica nos la dio el mismo aparato, pero disponiendo de dos termómetros podemos anotar los datos y luego hacer la gráfica.
Los recursos electrónicos nos permiten hacer más rápidas y más bonitas las gráficas, pero los conceptos que se descubren se pueden obtener igualmente aunque no dispongamos de tantos recursos.

¿Puedes saber la temperatura inicial del foco caliente viendo la gráfica? ¿Y del foco frío? ¿Cuál fue la temperatura final? ¿Cuánto tardaron en igualarse las temperaturas?
En el punto en que se igualan las T el foco frío queda momentáneamente a una temperatura inferior debido a un error de lectura experimental. Una agitación continuada de los dos líquidos en contacto las igualará.
Si dejamos el sistema abandonado las temperaturas del agua del tubo y del vaso continuarán iguales y empezarán a descender al mismo tiempo, porque los alrededores están a menor temperatura.
Las pendientes de las curvas obtenidas en los registros de las temperaturas hacia el equilibrio dependen de las masas y de los calores específicos de las sustancias puestas en contacto.
Si la curva de enfriamiento y la de calentamiento tienen la misma pendiente (una creciente y la otra decreciente) ¿qué puedes deducir?
¿Estará relacionado con que la masa del líquido caliente es igual a la del frío y se trata de las mismas sustancias?
Descargar
| Enviado por: | Pedro Tucto Bustamante |
| Idioma: | castellano |
| País: | Perú |