Enfermería
Antiepilépticos
N03. antiepilePticos
L
os medicamentos incluidos en este apartado actúan reduciendo el ritmo acelerado de descarga neuronal inductor de las convulsiones, pero no afectan a la etiología.
Tradicionalmente el grupo se ha basado más en la experiencia clínica que en el conocimiento farmacológico. Por ello se han dividido en antiepilépticos efectivos en ataques tónicos-clónicos (gran mal) y los efectivos en ataques de ausencia (pequeño mal). Pero en la última década se ha avanzado mucho en el conocimiento de los fenómenos electrofisiológicos que intervienen en la transmisión del impulso neuronal y del mecanismo de acción de los anticonvulsivantes.
En el mecanismo de despolarización/repolarización de la neurona intervienen principalmente los iones sodio y cloruro, que atraviesan la membrana celular por canales específicos. La despolarización mediada por el ión calcio sólo parece ser importante en las estructuras talámicas donde se originan los cuadros generalizados.
La trasmisión del impulso nervioso a nivel sináptico está mediada por dos neurotrasmisores principales: el ácido glutámico, que actúa como excitador favoreciendo la despolarización de la neurona al abrir los canales iónicos de Na+, y el GABA que ejerce papel inhibidor al inducir la apertura de canales de Cl-. Los anticonvulsivantes pueden actuar por tanto a dos niveles: inhibiendo la acción de ácido glutámico o favoreciendo la acción del GABA. Por otra parte el mecanismo de acción puede centrarse en la liberación del neurotrasmisor a nivel presináptico o en la acción sobre los canales iónicos a nivel potsináptico.
En la Tabla I clasificamos los medicamentos comercializados de acuerdo con estos criterios. Como puede verse, el único hueco farmacológico es que en estos momentos no hay fármacos que inhiban directamente la liberación presináptica de ácido glutámico. Todas las demás posibilidades están cubiertas por uno o varios medicamentos. El ácido valproico es una molécula con multiplicidad de acciones y por tanto difícil de clasificar.
Los criterios farmacológicos permiten hacer una clasificación más racional de los medicamentos, e incluso sacar algunas conclusiones prácticas importantes, pero como norma general van a tener poca influencia en la selección de la terapia apropiada, que sigue teniendo mucho de empírica y donde es importante la respuesta individual y los efectos adversos los medicamentos. La Tabla III recoge las recomendaciones generales de tratamiento para los tipos principales de epilepsia.
inicio del tratamiento
Una cuestión en debate es la conveniencia de iniciar el tratamiento tras el primer ataque. Un porcentaje variable (las estimaciones van del 16 al 62%) de los pacientes que sufren un episodio convulsivo no vuelve a tener otro aunque no haya sido medicado. Por consiguiente, la norma general es esperar al segundo ataque antes de iniciar el tratamiento.
En adultos puede ser difícil aplicar esta regla por las repercusiones laborales, en la conducción de automóviles, etc. En cualquier caso la decisión de introducir una terapia antiepiléptica crónica sobre la base de un único episodio debe ser sopesada cuidadosamente teniendo en cuenta los factores de riesgo de recurrencia (electroencefalograma anormal, historia familiar de epilepsia, lesión neurológica previa, etc.).
Ensayos controlados han establecido que un 60% de los pacientes responden bien al primer fármaco ensayado y un 55% de los restantes terminan respondiendo a la monoterapia mediante cambio de medicación. Sólo un 10% de los pacientes obtienen mayor beneficio de una combinación de medicamentos que de un régimen monoterápico. Este concepto ha cambiado el enfoque del tratamiento antiepiléptico, que tradicionalmente se basaba en un régimen escalonado aditivo que desembocaba rápidamente en la politerapia. La idea prevalente en la actualidad es el cambio de medicación hasta encontrar el adecuado.
En cualquier caso, la clave del tratamiento antiepiléptico reside en buscar un equilibrio entre la eficacia y los efectos colaterales. La dosis debe ajustarse individualmente para cada paciente. Ayuda bastante un buen conocimiento de las características farmacocinéticas y en muchos casos es útil la determinación de niveles plasmáticos (ver tabla II).
En particular es importante tener en cuenta el tiempo que tarda cada medicamento en alcanzar niveles plasmáticos estables, porque un cierto número de fracasos de la terapia son atribuidos al abandono prematuro del fármaco por no obtener respuesta en un plazo corto.
tabla i. clasificacion de ANTIEPILÉPTICOS
| INHIBIDORES DE LA EXCITACIÓN | |
| Bloquean los canales de Na+. Los bloqueantes puros de sodio son efectivos en ataques parciales y secundariamente generalizado, y en cuadros generalizados tónico-clónicos, pero no lo son en cuadros de ausencia: en algunos casos (carbamazepina) pueden agravarlos. | |
| Carbamezapina | Muchos clínicos la consideran de primera elección en epilepsias parciales o secundariamente generalizadas. |
| Fenitoína | Posiblemente el antiepiléptico más experimentado. La eficacia es semejante a la de carbamazepina pero el margen terapéutico es muy estrecho. Es importante controlar los niveles plasmáticos. |
| Lamotrigina | El mejor estudiado de los nuevos antiepilépticos, pero aun falta algo de experiencia. La eficacia parece semejante a los dos anteriores, la tolerancia general es mejor. Puede producir erupciones cutáneas que a veces obligan a suspender el tratamiento. Es útil en cuadros parciales o generalizados resistentes a la terapia tradicional, y se acepta ya como primer tratamiento. Hay evidencia anecdótica de que puede ser eficaz en ausencias, pero no hay ensayos concluyentes. |
| Acido Valproico | Tiene un mecanismo de acción múltiple y como consecuencia es el antiepiléptico de mayor amplitud de acción disponible, especialmente útil en cuadros mixtos. Su aplicación está limitada por los problemas de hepatoxicidad (muy raros, pero graves) que aparecen generalmente en niños menores de dos años bajo politerapia, sobre todo si tienen otras patologías concurrentes. |
| Topiramato | Actúa a un triple nivel, lo que justifica en parte la amplitud de su espectro:
Además de las acción citadas, el topiramato desarrolla un leve efecto inhibidor de la anhidrasa carbónica. Aunque este último efecto no parece colaborar sustancialmente en la acción antiepiléptica, sí es responsable de la aparición de algunos efectos colaterales (reducción de peso y urolitiasis, fundamentalmente). No está estructuralmente relacionado con otros antiepilépticos. Tiene un amplio espectro antiepiléptico, bajo riesgo de interacciones, aceptable perfil toxicológico (ausencia de hemato y hepatotoxicidad, especialmente) y farmacocinética favorable (que permite una dosificación relativamente cómoda). Todo ello asociado a buenos niveles de eficacia clínica en ciertos cuadros epilépticos refractarios a tratamientos convencionales, así como en ciertas patologías epilépticas de difícil tratamiento, como el síndrome de Lennox-Gastaut. En su debe hay que anotar la relativamente alta incidencia de efectos cognitivos, aunque mayoritariamente leves y transitorios. |
| Felbamato | La acción farmacológica es compleja y no se conoce bien: inhibe las corrientes de Na+ y potencia la acción del GABA. Aunque los datos iniciales de seguridad eran favorables, el felbamato ha demostrado en el uso clínico que es un fármaco problemático. La tolerancia general no es buena y tiene un potencial significativo de interacciones. Pero sobre todo, se han descrito cuadros de anemia aplásica y hepatotoxicidad grave. |
| Bloquean los canales de Ca++. Los bloqueantes puros de calcio tienen eficacia restringida, centrada especialmente en los ataques de ausencia. | |
| Etosuximida | Considerado uno de los fármacos de elección en ataques de ausencia, tiene pocas indicaciones adicionales. Los efectos adversos son frecuentes pero raramente graves. |
| Acido Valproico | Ver comentario en la sección anterior. |
| POTENCIADORES DE LA INHIBICION | |
| Acción directa (GABA-érgica) sobre canales de Cl-. Los medicamentos de este grupo tienen el inconveniente general de producir sedación, por lo que no se consideran de primera elección. Los barbitúricos tienen una acción equivalente a los antagonistas de sodio. Las benzodiazepinas tienen espectro anticonvulsivo más amplio. | |
| Barbitúricos | El fenobarbital fue el primer antiepiléptico eficaz y sigue conservando su utilidad terapéutica. Tiene menos efectos secundarios no relacionados con el SNC que la mayoría de las alternativas, pero los efectos centrales (somnolencia e hiperkinesia en niños) lo han relegado a tratamiento de segunda línea. El metilfenobarbital se transforma en fenobarbital en el organismo, la primidona lo hace también parcialmente. |
| Benzodiazepinas | Teóricamente las benzodiazepinas tienen un espectro de acción anticonvulsivante muy amplio, pero en la práctica el diazepam y el lorazepam son activos únicamente por vía IV. El lorazepam tiene mayor duración de acción que el diazepam. El clonazepam mantiene la acción por vía oral, pero a la dosis necesaria para controlar ataques parciales y generalizados produce una incidencia alta de depresión central. El clobazam tiene menos tendencia a producir sedación. Se usa sólo en casos refractarios al tratamiento convencional. Inconvenientes generales de las benzodiazepinas son la pérdida de eficacia en tratamientos prolongados y que la suspensión induce la reactivación de los ataques. |
| Estimulan la liberación presináptica del GABA. Son medicamentos nuevos y por tanto comparten las características de estar poco experimentados (se han ensayado como terapia adicional en cuadros refractarios) y de tener en principio menos efectos adversos que los antiepilépticos clásicos. | |
| Vigabatrina | Producen acumulación de GABA por inhibición irreversible del enzima GABA-transaminasa. Eficaz en cuadros parciales y tónico-clónicos generalizados primaria o secundariamente. La incidencia de efectos adversos es baja, pero ocasionalmente puede causar trastornos psiquiátricos reversibles. |
| Gabapentina | Desarrollado como agonista en receptores postsinápticos de GABA, pero ese no parece ser su mecanismo de acción, que permanece desconocido. Su adscripción a este grupo es provisional. Se usa por el momento en cuadros parciales o secundariamente generalizados resistentes al tratamiento convencional. La tolerancia parece bastante buena. La semivida plasmática es corta, necesitando tres administraciones diarias. |
| Tiagabina | Inhibe de la captación del GABA por las neuronas y las célula de la glía, incrementando así la concentración del GABA en el espacio sináptico y con ello la capacidad neuroinhibitoria de este neurotransmisor. Presenta un perfil toxicológico relativamente benigno. |
| Topiramato | Ver comentario en la primera sección. |
| Acido Valproico | Ver comentario en la primera sección. |
tabla ii.
caracteristicas farmacocineticas de los antiepilepticos
| MEDICAMENTO | Dosis terapéuticas usuales*. | Tiempo hasta niveles constantes. | Necesidad de |
| Primidona | 250-1500 mg | 2-3 días | Poco importante. Se metaboliza parcialmente a fenobarbital pero el fármaco y otro metabolito son también activos. |
| Carbamazepina | 400-2000 mg | 3-6 días | Bastante útil para establecer la dosis óptima. |
| Clobazam | 10-40 mg | 5-7 días | Como clonazepam. |
| Clonazepam | 2-8 mg | 4-6 días | Utilidad desconocida. No parece que se haya establecido el rango terapéutico. |
| Etosuximida | 500-2000 mg | 5-11 días | Puede ayudar, pero es mejor basar la dosis en la respuesta clínica. |
| Felbamato | 1800-4800 mg | 1 día | Utilidad desconocida. |
| Fenitoína | 200-500 mg | 7-8 días | Muy importante |
| Fenobarbital | 60-240 mg | 14-21 días | Relativamente importante. Existe un fenómeno de acostumbramiento en administración continuada que puede desvirtuar la utilidad de la medida. |
| Gabapentina | 900-1800 mg | 1 día | Utilidad desconocida. No se ha establecido el rango terapéutico. |
| Lamotrigina | 200-400 mg | 2-3 días | Utilidad desconocida. No se ha establecido el rango terapéutico de la lamotrigina. |
| Tiagabina | 16 mg 12 h | 1 día | Utilidad desconocida. No se ha establecido el rango terapéutico. |
| Topiramato | 400 mg 12 h | 3 días | Utilidad desconocida. No se han observado diferencias notables entre utilizar directamente la dosis sugerida o realizar una titulación de la dosis a lo largo de tres días. |
| Valproico, ácido | 600-2500 mg | 12-15 días | No es muy útil. No hay relación satisfactoria entre niveles y actividad terapéutica. |
| Vigabatrina | 500-2000 mg | 1 día | No es útil. El efecto no depende de la concentración plasmática de vigabatrina sino de la acumulación de GABA en las sinapsis. |
*Dosis diarias usuales de mantenimiento para adultos.
tabla iii. tratamiento farmacologico de la epilepsia
| ATAQUES GENERALIZADOS | |
| Ataques tónico-clónicos | Teniendo en cuenta que la mayoría de los pacientes son jóvenes, se prefiere usar fármacos que produzcan poca sedación, para no interferir en el rendimiento escolar. Este criterio ha relegado a segunda línea los barbitúricos y las benzodiazepinas. Los medicamentos más usados son la carbamazepina y el valproato sódico. La eficacia de los dos es parecida, pero el valproato sódico despierta ciertas prevenciones por el riesgo de hepatotoxicidad. Es el medicamento de elección en cuadros que llevan asociados ataques de ausencia o mioclónicos. La fenitoína es también eficaz pero el margen terapéutico es estrecho y tiene efectos secundarios que afectan a la estética (hirsutismo, hiperplasia gingival) y la hacen poco apropiado para adolescentes. La lamotrigina es una alternativa con buena tolerancia en adultos, pero falta experiencia como monoterapia en niños. La combinación valproato sódico + lamotrigina pueden ser una elección de buen resultado en los cuadros que no respondan a monoterapia. |
| Ataques de ausencia | La etosuximida y el valproato sódico tienen eficacia parecida (quedan libres de ataques entre la mitad y dos tercios de los pacientes). Se suele preferir la etosuximida por no producir hepatotoxicidad, pero en cuadros complejos donde la ausencia sea uno de los componentes se usa el valproato. Las benzodiazepinas son válidas también, particularmente cuando la ausencia está asociada a ataques mioclónicos, pero la acción se pierde. Los cuadros refractarios a monoterapia se tratan con la asociación etosuximida+valproato. |
| Ataques mioclónicos | El valproato sódico es muy efectivo. En caso de fracaso usar clonazepam. El resto de los medicamentos son mucho menos eficaces. |
| Ataques parciales | Se usan los mismos fármacos que en los ataques generalizados tónico-clónicos, y con los mismos criterios de selección. En general los ataques parciales responden peor que los generalizados, por lo que hay que ensayar más medicamentos, incluyendo los más recientes. En caso de no responder a monoterapia, se recurre a combinaciones como son carbamezapina o fenitoína con dosis bajas de fenobarbital, o bien valproato sódico con carbamazepina, fenitoína, gabapentina o vigabatrina. |
suspension del tratamiento
El tiempo que debe mantenerse un tratamiento antiepiléptico es una cuestión delicada. Algunos pacientes necesitarán seguir la terapia de por vida, pero es un hecho comprobado que un porcentaje elevado no recaen una vez suspendida la medicación.
Es muy difícil predecir qué pacientes van a mantener la normalidad sin tratamiento. Se han hecho intentos, hasta ahora sin demasiado éxito, de identificar factores de pronóstico. Parece que son factores desfavorables presentar anormalidades neurológicas, ataques de más de un tipo, necesitar más de un medicamento o la epilepsia iniciada en la edad adulta. Pero la única forma de dilucidar definitivamente cada caso es hacer la prueba.
En niños que han pasado dos años sin ataques, el índice de remisión es algo superior al 75%. En adultos es del orden del 60%.
Muchos autores recomiendan una retirada muy gradual de la medicación una vez transcurridos dos años sin ataques. Otros aconsejan esperar cuatro años.
En cualquier caso conviene discutir el tema de la retirada con los pacientes adultos, porque la recurrencia de las convulsiones puede crear dificultades en el trabajo o en la obtención del permiso de conducir.
| Cualquiera que sea la causa, la retirada de un antiepiléptico debe hacerse siempre lentamente. Si fuese precisa una retirada súbita, sustituir rápidamente por otro. La suspensión brusca de la medicación anticonvulsivante comporta el riesgo de precipitar un cuadro de status epilépticus. |
tratamiento del ESTADO DE MAL EPILÉPTICO (status epilepticus)
La definición del estado de mal epiléptico o status epilepticus ha variado notablemente en los últimos años. Actualmente, se aplica el término a cualquier ataque epiléptico continuo que dure al menos cinco minutos, o bien a la sucesión de dos o más ataques entre los cuales no se produzca una recuperación completa de la consciencia.
Entre un 15% y un 30% de los pacientes adultos que son diagnosticados de epilepsia, tienen como primera manifestación de la enfermedad un cuadro de estado de mal epiléptico. De hecho, se trata de una emergencia clínica cuya mortalidad global en adultos alcanza el 20%.
El fundamento fisiopatológico de esta condición implica un fracaso de los mecanismos de abortan normalmente los ataques epilépticos aislados.
El tratamiento inicial de un paciente con estado de mal epiléptico incluye un conjunto de medidas estándar, aplicables a cualquier situación de emergencia clínica. Básicamente, consisten en las siguientes:
Despejar las vías respiratorias y controlar el flujo aéreo.
Monitorizar los principales signos vitales (inclyendo la temperatura corporal).
Realizar pruebas gasométricas sanguíneas y monitorizar la función cardíaca.
Realizar una determinación rápida de la glucemia.
Administrar por vía IV tiamina (100 mg) y glucosa (50 ml de dextrosa al 50%).
El objetivo terapéutico esencial del estado de mal epiléptico es acabar lo más rápidamente posible con la actividad epiléptica. Para ello, lo ideal sería contar con fármacos fáciles de administrar, de acción rápida y prolongada y carentes de efectos adversos serios especialmente sobre la función cardiorrespiratoria. La realidad, sin embargo, difiere notablemente de esas premisas terapéuticas, ya que tales fármacos sencillamante no existen.
En cualquier caso, en la práctica clínica debe iniciarse sin ningún retraso el tratamiento farmacológico del estado de mal epiléptico, ya que cuanto más tarde se instaure tanto más dificil será el control del proceso. En este sentido, hay datos contrastados que indican niveles de respuesta por encima del 80% de los pacientes que inician el tratamiento hasta media horas tras el inicio del ataque; por el contrario, cuando se instaura el tratamieno dos horas más tarde desde el inicio del cuadro, el porcentaje de pacientes que responden es inferior al 40%.
En el cuadro I se recoge uno de los esquemas terapéuticos más utilizados, que utiliza fármacos cuya selección se basa en la rapidez y duración del efecto antiepiléptico.
Los primeros fármacos en ser utilizados son las benzodiazepinas, debido a su elevada potencia y rapidez de acción, en especial diazepam y lorazepam. Aunque ambos fármacos son considerados como equivalentes desde el punto de vista farmacológico, se prefiere el lorazepam debido a su mayor duración de efectos (12-24 h) en relación al diazepam (15-30 min).
La fenitoína es útil para el mantenimiento de un efecto antiepiléptico prolongado, después de haber conseguido finalizar el ataque mediante una benzodiazepina o bien cuando ésta no produce el efecto esperado.
Por su parte, el fenobarbital produce una eficacia similar a la combinación diazepam/fenitoína en status epilepticus. Sin embargo, el efecto depresor del barbitúrico sobre la función respiratoria, el nivel de consciencia y la presión sanguínea pueden complicar notablemente el tratamiento, en especial si el fenobarbital se administra a continuación de la benzodiazepina. De ahí, que el fenobarbital sea considerado sólo como una alternativa cuando otras opciones terapéuticas han fracaso.
En el caso de que un estado de mal epiléptico no responda a ninguno de los tratamientos antes indicados se recurre a la infusión IV continua de dosis anestésicas de midazolam, propofol o tiopental.
Como es evidente, la aparición de una crisis de status epilepticus no es previsible y, por lo tanto, es poco probable que tal condición se produzca en un entorno hospitalario que permita un pronto tratamiento. Por ello, existen alternativas que permiten un tratamiento precoz. Así, por ejemplo, la administración intramuscular de midazolam (0,15-0,3 mg/kg) permite controlar el ataque en menos de 10 minutos en la mayoría de los pacientes, tanto pediátricos como adultos. Tambien la administración rectal de diazepam (enema de 0,5 mg/kg, hasta un máximo de 20 mg) permite obtener un control en niños, en apenas 15 minutos.
CUADRO I. ALGORITMO PARA EL TRATAMIENTO DEL
ESTADO DE MAL EPILÉPTICO 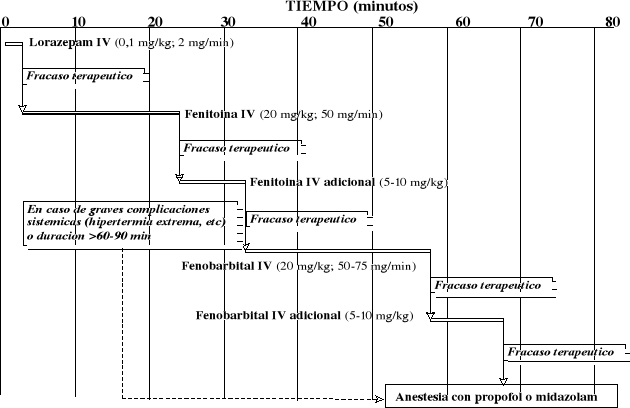
(STATUS EPILEPTICUS)
tratamiento de convulsiones febriles infantiles
Tratamiento de urgencia
El medicamento de elección es el diazepam por vía rectal. Con las formas líquidas en enema se obtienen niveles sanguíneos eficaces en 3-4 minutos. Los supositorios tardan de 15 a 20 minutos en proporcionar concentraciones eficaces y deben reservarse para regímenes profilácticos.
El cuadro II es un esquema para el tratamiento de urgencia. Se refiere exclusivamente a tratamiento farmacológico y no incluye otras medidas como mantener despejadas las vías aéreas e intentar bajar la temperatura del paciente.
Profilaxis
Las convulsiones febriles infantiles, incluso las complicadas, tienen un riesgo muy bajo de epilepsia o secuelas neurológicas permanentes. La profilaxis continuada con fenobarbital o ácido valproico sólo está justificada en casos muy especiales.
La administración de diazepam rectal en caso de fiebre alta (más de 38ºC) reduce de forma muy significativa el riesgo de convulsión o las posibles complicaciones caso de producirse. En niños menores de tres años se administran dosis de 5 mg cada 12 horas (en enemas) o cada 8 horas (en supositorios), comenzando lo antes posible y continuando un máximo de 48 horas. Si es necesario repetir el tratamiento, dejar transcurrir 24-48 horas para evitar la acumulación del diazepam.
CUADRO II. ALGORITMO PARA EL TRATAMIENTO DE
CONVULSIONES FEBRILES INFANTILES
| |
Loweinstein DH, Alldredge BK. Status epilepticus. N Engl J Med 1998; 338: 970-6.
En caso de urgencia y si no se dispone de una forma en enema puede intentarse la administración rectal usando la presentación de diazepam para uso intravenoso en una jeringuilla de 2 ml acoplada a un tubo de plástico blando de 4 a 5 cm de longitud.
Diazepam rectal: 0,5 mg/kg
Niños menores de 1 año: 2-4 mg.
De 1 a 2 años: 5 mg.
Más de 2 años: 7,5 mg
Repetir dosis a los 5 minutos
Ingreso en hospital
Diazepam IV: 0,2-0,5 mg/kg a 1 mg/min.
Seguir diazepam IV hasta dosis total
(IV + rectal) de 2-3 mg/kg en 30 minutos.
Fenitoína IV 15-20 mg/kg a 0,5 mg/kg/min. O bien:
Fenobarbital IV 10 mg/kg a 1 mg/kg/min.
Descargar
| Enviado por: | Francisco J. Molina |
| Idioma: | castellano |
| País: | España |
