Análisis y control
Análisis de agua
INTRODUCCIÓN:
El agua es una sustancia, incolora, inodora e insabora cuyas cualidades le confieren una importancia vital para el desarrollo de los procesos biológicos que dan origen a la vida; así como los ciclos meteorológicos que llevan consigo, un equilibrio biológico vital. Además esta presente en casi todos los procesos de cualquier índole y esta considerada como el disolvente universal.
Estas propiedades se deben a sus propiedades físicas y químicas: Punto de fusión de 0ºC, punto de ebullición de 100ºC, la densidad de 1g/cm3, se comporta como anfótero, y la que se podría considerar más importante ya que, probablemente, todas las propiedades, tanto físicas como químicas, dependan de esta característica: La formula del agua es H2O, pero esta no es una molécula lineal, formando puentes de hidrógeno forma un triangulo con un ángulo de 104,5º de la siguiente forma:

Esta unión se produce por un enlace covalente entre el oxigeno y el hidrógeno, pero con cierta influencia del enlace iónico debido la alta electronegatividad de ambos elementos. La fuerza de los enlaces es tan grande que entra dentro de los puentes de hidrógeno. Esto es lo que hace que el agua aumente de volumen al solidificar y que cuando lo haga sea formando cristales hexagonales de esa forma tan compacta.
El agua es esencial para la vida. Por esta razón debemos insistir en la relación entre el agua y la salud. La disponibilidad y la calidad del agua determinan el grado de salud e higiene de cualquier sociedad. El agua y la salud son dos aliados estratégicos y contribuyen al sostenimiento y a la calidad de la vida.
El agua potable, es decir, apta para consumo. Contiene en disolución determinadas sales esenciales para la vida, que tienen, entre otras funciones, el fin de garantizar la osmosis celular; ya que sin la presencia de estas sales en disolución, el agua seria letal porque sin la existencia de la osmosis, las células se llenarían de agua hasta romper la pared celular de esta. Estas son, entre otras, Cl-, el CaCO3, MgCO3, NO3-, O2, F- y CO2 (en el caso de aguas con gas). Sin embargo, de estos compuestos, existen limites mínimos y máximos para considerarla potable.
No obstante el agua también puede contener, disueltas determinadas sustancias, como pueden ser los NO2- que las convierten en aguas potencialmente nocivas o toxicas.
En el agua, también se debe tener en cuenta la posibilidad del desarrollo de determinados microorganismos, como el E-COLI (así como los microorganismos fecales en general) o la SALMONELLA. Cuya presencia debe ser nula.
LEGISLACIÓN:
-
ORDEN de 27 de Julio de 1983 (BOE de 31 de agosto de). Métodos oficiales de análisis microbiológico de aguas potables de consumo publico
-
ORDEN de 8 de mayo de 1987 (BOE de 13 de mayo). Se aprueban los métodos de análisis microbiológico para la elaboración, circulación y comercio de aguas de bebida envasadas.
-
ORDEN de 1 de julio de 1987 (BOE de 9 de julio). Se aprueban los métodos oficiales de análisis fisicoquímico para aguas potables de consumo publico. Corrección de errores en BOE de septiembre de 1987.
-
REAL DECRETO 1130/1990 de 14 de septiembre (BOE de 20 de septiembre). Se aprueba la reglamentación Técnico-sanitaria para el abastecimiento y control de calidad de las agua potables de consumo publico. Corrección de errores en BOE de 24 de noviembre de 1990.
-
REAL DECRETO 1074/2002
DETERMINACIONES:
RESIDUO SECO (B.O.E. de 9-07-1987)
Fundamento teorico
Se podría definir el residuo seco como la cantidad de materia sólida (expresada en miligramos) contenida en un litro de agua. De esta característica depende directamente la calidad del agua. Es una expresión generalizada de todos los compuestos sólidos disueltos y en suspensión en un volumen conocido de agua. Su limite se encuentra en 1500 mg/L y su cantidad optima es inferior a 500 ppm.
principio del metodo
La cantidad de residuo seco se obtendrá mediante una gravimetría, en la que tras la evaporación completa del agua se obtiene su contenido en sustancias sólidas exentas de agua.
material y aparatos
-
Cápsula de porcelana
-
Baño de agua
-
Estufa
-
Pipeta de 25ml
-
Material general de laboratorio
procedimiento operatorio
Evaporación de agua ! Desecación del residuo sólido
-
Pesar una cápsula de porcelana perfectamente limpia y seca.
-
En dicha cápsula de porcelana poner 200ml de agua
-
Evaporar el agua a 70ºC
-
Cuando el agua este evaporada casi en su totalidad, introducir la cápsula en la estufa a 180ºC durante dos horas.
-
Se pesa la cápsula con el residuo sólido completamente seco y por diferencia se calcula el valor del residuo seco.
expresion de los resultados: Muestra Nº 8
Datos de la practica:
| M0= | 48.5314 | M0 = Masa de la cápsula |
| V= | 200ml | V = volumen de muestra |
| M1= | Se rompió la cápsula de manera fortuita | M1 = Masa de cápsula + residuo seco |
Cálculos
mg/L = (M1 - M0)*1000/V
Resultados
Se rompió la cápsula y no se obtuvieron resultados
Observaciones:
-
Se rompió la cápsula por causas ajenas al analista y no se pudo completar la determinación
referencias bibliograficas
-
Apuntes de clase
-
http://www.ambientum.com/enciclopedia/aguas/2.01.18.26_1r.html
Dureza (B.O.E. de 9-07-1987)
fundamento teorico
El agua contiene, entre otras sales, CaCO3 y MgCO3. Estas son la confieren al agua la denominada dureza. Esta se mide con tres parámetros:
-
Dureza total, que es la cantidad en mg/L de ambas sales expresada en forma de mg/L de CaCO3 y cuyo limite máximo se encuentra en 50 ºHT y su valor optimo en 15ºHT y sus calidades son las siguientes:
| Dureza | ºHT |
| Calidad optima | 15 |
| Calidad media | 30 |
| Calidad aceptable | 50 |
| Calidad muy mala | 60 |
Este parámetro es indicativo directo de la calidad del agua y es uno de los más importantes.
-
Dureza cálica, que es el contenido de calcio expresado en mg/L, cuyo valor optimo es de 100 mg/L y el valor máximo 200mg/L
-
Dureza Magnésica, que es la cantidad de magnesio expresada en ppm, presente en la muestra de agua y que tiene un valor orientativo de la calidad de 30mg/L y no tiene un valor máximo establecido; pero se sabe que por encima de 125mg/L tiene efectos laxantes.
principio del metodo
La determinación consiste en una complexometria con EDTA en presencia de NET y de calceina.
material y aparatos
-
Matraz aforado de 50ml
-
Pipeta de 25ml
-
Matraz erlenmeyer
-
Material general de laboratorio
reactivos
-
EDTA
-
Tampón pH = 10 (ANEXO II)
-
NaOH 1N
-
Complexón magnesio
-
Calceina
procedimiento operatorio
Valoración de la muestra
Dureza total
-
Tomar 50 ml de la muestra o una porción diluida y pasarla a un erlenmeyer de 250ml
-
Añadir 2 ml de la solución tampón
-
Añadir un poco de N.E.T. La solución tomará un color rojizo
-
Finalmente, valorar con EDTA. hasta el viraje de la solución a color azul
Dureza cálcica
-
Tomar 50 ml de muestra en un matraz erlenmeyer de 250 ml
-
Añadir 1ml de NaOH 1N
-
Añadir con la espátula un poco del indicador (calceina).
-
Titular inmediatamente con EDTA
Dureza magnesica
-
Se obtiene por diferencia, entre el volumen de EDTA gastado para la dureza total y el gastado para la dureza cálcica.
expresion de los resultados
Datos de la practica
Dureza total
| Vm (ml)= | 50 | Vm = Volumen de muestra |
| V (ml)= | 15.1 | V = Volumen de EDTA gastado |
| CEDTA (M)= | 0.01 | CEDTA = Concentración del EDTA |
Dureza cálcica
| Vm (ml) = | 50 | Vm = Volumen de muestra |
| V (ml)= | 10.1 | V = Volumen de EDTA gastado |
| CEDTA (M)= | 0.01 | CEDTA = Concentración del EDTA |
Cálculos
Dureza Total
ºHT = VEDTA · 103 · 0.01 · 100.06 · 102 · 103 / Vm
Dureza cálcica
Ppm Ca =
Dureza magnesica
Ppm Mg = (VEDTA(DT) - VEDTA(Dca)) · 0.01 · 24.3· 103 / Vm
Resultados
| Dureza total (ºHT) | 30.2 |
| Dureza cálcica (ppm) | 81 |
| Dureza magnesica (ppm) | 24.31 |
observaciones
No hay incidencias reseñables para esta determinación
referencias bibliograficas
-
Apuntes de clase
-
http://tar5.eup.us.es/master/analisis/metodo_es.htm
Fluoruros (B.O.E. de 9-07-1987)
fundamento teorico
Los fluoruros es uno de los aniones que se encuentran disueltos en el agua en forma de sales. Este ion es también característico de la calidad del agua y el limite máximo se encuentra en 1.5mgF-/L. Y las que contienen mas de 1ppm se denominan ferruginosas. Por encima del limite se puede comenzar a sospechar que se trata de agua contaminadas.
principio del metodo
Consiste en una Potenciometria por electrodos selectivos.
material y aparatos
-
Potenciómetro
-
Pipeta de 10ml
-
Electrodo de fluoruros
-
Material general de laboratorio
reactivos
-
Patrón de 1000ppm de F-
-
Solución amortiguadora (TISAB). Disolver en un litro de agua desionizada 58,5 g de Sodio Cloruro, 15 cm3 de Ácido Acético glacial, 102,06 g de Sodio Acetato 3-hidrato y 0,3 g de tri-Sodio Citrato 2- hidrato, comprobando que su pH queda comprendido entre 5,00 y 5,50. Ajustar si es necesario.
procedimiento operatorio
Preparar patrones y muestra ! Medida de patrones y muestras
-
Preparar disoluciones de 1ppm y 10ppm de F- a partir de la disolución patrón de 1000ppm.
-
En un vaso echar 20ml de solución patrón de 1ppm y 20 de TISAB.
-
Medir la mezcla en el potenciómetro.
-
En otro vaso echar 20ml de la disolución patrón de 10ppm en un vaso y 20ml de TISAB
-
Medir la disolución en el potenciómetro.
-
Dibujar la recta de calibrado.
-
En un vaso echar 20ml de muestra y 20ml de TISAB.
-
Medir la muestra.
-
Extrapolar o interpolar (según sea necesario) en la grafica el resultado de la muestra. El resultado es valido, siempre y cuando supere los 0.2mgF-/L.
expresion de resultados
Datos de la practica (ANEXO I)
| mv Patron 1ppm | 80 |
| mv Patron 10ppm | 31 |
| mv Muestra (20ml) | 104 |
Resultados
| Ppm F- Muestra de agua = | 0.3 |
observaciones
Si el resultado obtenido es inferior a 0.2ppm es demasiado impreciso para esta recta.
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Conductividad (B.O.E. de 9-07-1987)
fundamento teorico
La Conductividad eléctrica es la capacidad del agua para conducir la electricidad y está relacionada con el grado de sales disueltas en el agua. Basándose en la definición de esta propiedad esta en función de concentración de iones en la muestra y, por lo tanto de la concentración de sales en el agua. De esta manera, teniendo en cuenta que las concentraciones de sales indican la calidad del agua, así que se podría decir que la conductividad es un indicativo de su calidad. El valor máximo establecido esta en 2500 µS/cm.
principio del metodo
Consiste en la medición de muestra con un potenciómetro calibrado a 20ºC
Material y aparatos
-
Conductímetro
-
Material general del laboratorio
reactivos
-
Patrones para calibrar el conductímetro
procedimiento opreratorio
-
Calibrar el conductímetro a 20ºC
-
Echar en un baso de 100ml un poco de muestra (la necesaria para sumergir en diafragme del electrodo)
-
Medir la muestra a 20ºC
expresion de los resultados
Conductividad = 596 µS/cm a 20ºC
Observaciones
-
Se realizo otra medida que se tubo que rechazar porque los patrones estaban en mal estado y el resultado obtenido fue: 426 µS/cm a 20ºC
bibliografia
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
hierro (Absorción atomica) (B.O.E. de 9-07-1987)
fundamento teorico
La concentración de hierro en agua puede variar entre 1µg/L y 2mg/L. Este metal se puede encontrar en el agua por varias fuentes; porque el agua disuelva hierro de las rocas o de las menas que lo contienen. Puede proceder también de las tuberías por las que es distribuida el agua.
Pero la fuente más importante es biológica. Cuando el hierro se encuentra en el agua en forma de Fe2O3 (insoluble) en suspensión. La materia orgánica consume el oxigeno y reduce el hierro a Fe2+, soluble en agua; Esto hace que determinadas aguas y en especial las subterráneas, tengan un alto contenido en hierro.
Este es un parámetro que nos permitirá determinar si el agua a sufrido vertidos o esta de alguna forma contaminada.
principio del metodo
Consiste en determinar mediante Absorción atómica la concentración de hierro en agua.
material y aparatos
-
Espectrómetro de absorción atómica.
reactivos
-
Patrones de hierro de 2, 4 y 6ppm
procedimiento operatorio
Preparación de la recta de calibrado ! Medida de la muestra
-
Utilizar agua destilada como blanco
-
Medir los patrones de hierro en espectrómetro
-
En un vaso de precipitados poner la muestra y medirla
expresion de resultados
Datos de la practica
| Patrones (ppm) | Absorbancia |
| 2 | 0.077 |
| 4 | 0.141 |
| 6 | 0.194 |
La recta de calibrado esta en el
Resultados
Muestra de agua = 0ppm
observaciones
No existen incidencias reseñables en esta determinación
REFERENCIAS BIBLIOGRAFICAS:
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Hierro (ultravioleta-visible, método con fenantrolina) (B.O.E. de 9-07-1987)
fundamento teorico
Es el mismo que es del análisis anterior
principio del metodo
Se hará una determinación de hierro mediante una espectroscopia Uv-visible, mediante el uso de fenantrolina.
material y aparatos
-
Espectrofotómetro ultravioleta-visible.
-
Matraz aforado de 100ml
-
Pipetas de 5, 10, 15, 20 y 25ml
reactivos
-
Solución patrón de Fe(II), 100 mg L-1, preparada disolviendo 0,7022 g de Fe(NH4)2(SO4)2.6H2O en 50 mL de 1:1 H2SO4 y diluyendo a 1000 mL con agua destilada.
-
Clorhidrato de hidroxilamina
-
NaAc
-
Fenantrolina
procedimiento operatorio
Preparación de la recta de calibrado ! Medida de la muestra
-
Preparar una disolución patrón de 20ppm
-
De esa disolución patrón tomar 0, 5, 10, 15, 20 y 25ml y echarlos en matraces de 100ml (disoluciones de 1, 2, 3, 4 y 5ppm)
-
Añadir a cada matraz 0.5ml de clorhidrato de hidroxilamina, 1.25ml de NaAc y 1.25ml de fenantrolina.
-
Enrasar los matraces y dejar reposar 5 minutos hasta que se desarrolle el color
-
Repetir el mismo proceso con la muestra
expresion de resultados
Datos de la practica
| Ppm Fe | Absorbancia | |
| 1 | 0.192 | R = 0.9999 |
| 2 | 0.403 | b = -0.003 |
| 3 | 0.602 | m = 0.2006 |
| 4 | 0.801 | |
| 5 | 0.995 | |
| Muestra | 0.004 |
Cálculos
Cm = (A - b)/m
Cm = concentración de la muestra
A = absorbancia
b = ordenada en el origen
m = pendiente
Resultados
Concentración de la muestra = 0ppm
observaciones
No existen incidencias reseñables en esta determinación
REFERENCIAS BIBLIOGRAFICAS:
-
Apuntes de clase
Na+ y K+ (Emisión atómica) (B.O.E. de 9-07-1987)
Fundamento teorico
El sodio y el potasio son dos metales imprescindibles para las reacciones celulares, son las principales encargadas de la osmosis celular. Además estas sustancias, son necesarias para numerosas reacciones metabólicas.
Estos dos metales se encuentran formando sales disueltas en el agua, que le podrían dar cierto carácter alcalino.
Sus limites son 200pmm para el Na y 3.1ppm para el K.
principio del metodo
El método consiste en una espectroscopia de Emisión atómica.
material y aparatos
-
Espectrómetro de E.A.A.
-
Matraces aforados de 100ml
-
Pipeta de 20ml
reactivos
-
Patrones de Na y K
procedimiento operatorio
Dilución de la muestra ! Medida de la muestra
-
Medir los patrones de 0, 1, 3 y 5 ppm de sodio y potasio para hacer una recta de calibrado
-
Calcular la dilución si fuera necesaria y diluirla
-
Medir la muestra
expresion de los resultados: Muestra Nº 8
Datos de la practica:
| Patrones (ppm) Na | Absorbancia | |
| 1 | 0.194 | V0 = 100ml |
| 2 | 0.425 | V1 = 20ml |
| 3 | 0.550 | |
| Patrones (ppm) Na | ||
| 1 | 0.105 | |
| 3 | 0.365 | |
| 5 | 0.560 |
Cálculos
Ppm Na = ppm0 · 100/20
Ppm0 = concentración de la dilución
V0 = Volumen de la dilución
V1 = Volumen de alícuota
Resultados
Na = 21.5 ppm
K = 1.2 ppm
Observaciones:
-
no se usa lantano porque esta agotado.
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Nitritos (B.O.E. de 9-07-1987)
Fundamento teorico
Los nitritos son productos inestables de los desechos orgánicos que se suelen transformar en nitratos, debido a la actividad bacteriana. Los nitritos son sustancias muy toxicas y que no deben encontrarse en las aguas de consumo, ya que corresponderían a los productos de las reacciones de sustancias vertidas en contaminación y también por el peligro que esta sustancia entraña para la salud. O, más raramente, producir amoniaco.
Su limite máximo se encuentra en 0.5ppm.
principio del metodo
Esta determinación consiste en una espectroscopia por absorción ultravioleta visible.
material y aparatos
-
Espectrofotómetro Uv-vis.
-
Matraces aforrados de 50ml
-
Pipetas de 1, 5, 10, 15 y 20ml
-
Material general del laboratorio
reactivos
-
Solución de nitritos de 100 ppm
-
Reactivo de Zambelli. Diluir 260 ml de Ácido Clorhídrico 35% con 500 ml de Agua destilada. Añadir 5,0 g de Ácido Sulfanílico y 7,5 g de Fenol, calentando suavemente hasta disolución. Dejar enfriar y agregar 135 g de Amonio Cloruro. Cuando todo está disuelto completar hasta 1 litro con Agua destilada.
-
Amoniaco al 25%
procedimiento operatorio
Preparación de la muestra ! Medida de la muestra
-
Tomar 0, 1, 5, 10, 15 y 20ml de solución de 100ppm de nititos
-
Añadir 2ml de zambelli y 2ml de amoniaco
-
Homogeneizar, esperar 30 mitritos y enrasar
-
Esperar 5 minutos y medir a 425nm
-
Realizar el mismo proceso con la muestra
expresion de los resultados
Datos de la practica:
| PATRONES ppm | Absorbancia | |
| 0.046 | 0.027 | b = 0.0006 |
| 0.23 | 0.118 | m = 0.51235 |
| 0.46 | 0.256 | R = 0.99997 |
| 0.69 | 0.353 | |
| 0.92 | 0.473 | |
| Muestra | 0.004 |
Cálculos
Cm = (A - b)/m
Cm = concentración de la muestra
A = absorbancia
b = ordenada en el origen
m = pendiente
Resultados
Ppm NO2- = 0ppm
Observaciones:
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
Nitratos (B.O.E. de 9-07-1987)
Fundamento teorico
El nitrógeno es uno de los componentes más importantes de la materia orgánica, y principalmente forma parte en la elaboración de las proteínas celulares. Los nitratos son necesarios para completar el metabolismo de las células y son el compuesto esencial de los aminoácidos.
La practica totalidad de los compuestos nitrogenados son frutos, además, de reacciones biológicas, pero este tipo de iones, puede tener también su origen en el terreno; cuando el agua es filtrada a través del suelo o es disuelta por una corriente de agua. Su limite esta en 50mg/L
principio del metodo
El análisis consistirá en una determinación por el método ultravioleta. Eliminando las interferencias de la materia inorgánica.
material y aparatos
-
Matraces aforados de 50ml
-
Pipetas de 1, 5, 10, 20 y 25ml
-
Espectrofotómetro Uv-vis
-
Material general de laboratorio
reactivos
-
Solución patrón A de nitrato: Disolver 0,7218 g de Potasio Nitrato en agua y diluir a un litro. Esta solución contiene 100 mg de N por litro (solución A).
-
Disolución patrón B de nitrato: Diluir 100 ml de la solución A en 1000 ml con agua, 1 ml contiene 10 microgramos de N o 44,3 microgramos de NO3.
-
Ácido clorhídrico 1N
procedimiento operatorio
Preparación de la recta de calibrado ! Medida de la muestra
-
En matraces de 50ml echar 0, 1, 5, 10, 20 y 25ml de patrón B y 2ml de HCl.
-
Hacer lo mismo con la muestra
-
Medir los patrones y la muestra, primero a 220nm y después a 275nm
expresion de los resultados
Datos de la practica:
Cálculos
Cm = (A - b)/m
Cm = concentración de la muestra
A = absorbancia
b = ordenada en el origen
m = pendiente
Resultados
ppm NO3- = 14.8ppm
Observaciones:
-
No hay incidencias reseñables
referencias bibliograficas
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
D.Q.O. (B.O.E. de 9-07-1987)
fundamento: La demanda química de oxigeno (D.Q.O.) puede considerarse como una medida aproximada de la demanda teórica de oxigeno, que es la cantidad de oxigeno necesaria para la oxidación de la materia orgánica que puede haber contenida en productos inorgánicos.
Si encontramos grandes cantidades de compuestos difícilmente oxidables el valor de la D.Q.O. se aleja del valor teórico.
DEFINICIÓN: Es la cantidad de oxigeno que es equivalente a la cantidad de dicromato consumido por la materia orgánica, tanto disuelta como en suspensión, cuando la muestra es tratada por dicho oxidante en unas condiciones perfectamente definidas.
PRINCIPIO: La muestra se somete a ebullición a reflujo en presencia de HgSO4 y de una cantidad exactamente conocida de K2Cr2O7 y de un catalizador que contenga Ag2+. Se realiza en medio, generalmente ácido, mediante H2SO4, por un periodo de tiempo determinado, mediante el cual, una parte del dicromato es reducida por las materias oxidables presentes.
El exceso de dicromato se valora con una solución de (NH4)2Fe(SO4)2 (sal de Mohr) en presencia de ferroina como indicador. Por ultimo se calcula la D.Q.O. a partir de dicromato reducido. 1 mol de dicromato " 1.5 moles de O2.
mATERIAL y aparatos:
-
Digestor para D.Q.O.
-
Tubos de digestión.
-
Tubos de reflujo
-
Material general de laboratorio
REACTIVOS:
-
H2SO4 4M
-
(NH4)2Fe(SO4)2 (sal del Mohr)
-
H2SO4 concentrado
-
K2Cr2O7 0.040M solución patrón
-
Ftalato ácido de potasio (KC8H5O4)
-
Ferroina, solución indicadora
PROCEDIMIENTO operatorio:
DETERMINACIÓN: Se ponen 10ml de muestra en uno de los tubos, se añaden 10ml de dicromato, porcelana y 15ml de sulfúrico.
Testigo: Se echan 10ml de patrón de ftalato, en lugar de muestra y hace la digestión. La demanda teórica de oxigeno es de 500 ppm y es satisfactoria una experiencia con el 96% de exactitud
blanco: Se realiza la digestión Sustituyendo la muestra por agua destilada
Se coloca el refrigerante y se deja hervir dos horas a 150ºC, se enfriar y se añaden 75ml de agua después de haber lavado el refrigerante con agua. Por ultimo se valora el exceso de dicromato con sal de Mohr en presencia de ferroina.
EXPRESIÓN de resultados:
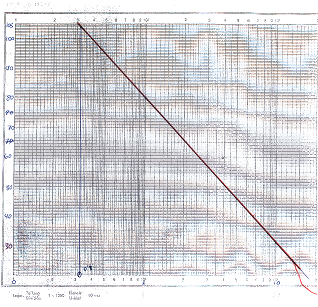
![]()
resultados: Los resultados se expresan en miligramos de oxigeno por litro.
Observaciones: Practica no realizada
BIBLIOGRAFÍA:
-
Apuntes de clase
-
Métodos oficiales de análisis (panreac)
oxidabilidad (B.O.E. de 9-07-1987)
Fundamento teorico
Existen sustancias en al que se pueden oxidar y es conveniente conocer su concentración, ya que una concentración demasiado baja podría ser indicio de la existencia de materia orgánica en la muestra, ya que esta se reduce y consume el oxigeno disuelto en el agua.
Esta, puede proceder de vertidos biológicos, que por la acción de las bacterias y las reacciones metabólicas de estas.
Otra fuente podría ser la aparición de detergentes en el agua, por contaminación con las sustancias de estos compuestos.
La cantidad mínima de oxigeno debe ser de 5ppm.
principio del metodo
Medición directa del oxigeno disuelto en agua con un electrodo redox
material y aparatos
-
Medidor de O2
-
Material general de laboratorio
-
procedimiento operatorio
-
En un vaso se echa un volumen necesario de muestra, se introduce el electrodo y se mide con agitación constante.
-
expresion de los resultados
-
Observaciones:
-
Estaba roto el cable del electro y se tubo que repetir la medida
-
referencias bibliograficas
-
Instrucciones del aparato
-
tabla general de resultados
-
conclusiones
-
Anexo I (Rectas de calibrado)
-
Fluoruros:
-
ANEXO II (Preparación de disoluciones)
-
Solución tampón de pH 10: Disolver 16.9 gr. De cloruro amónico (NH4Cl) en 143 ml. De hidróxido de amonio ( NH4OH) concentrado y diluir hasta 250 ml. Con agua destilada. Conservar en un recipiente de plástico o vidrio boro silicato, durante un tiempo no superior a un mes. Taponar herméticamente para evitar pérdidas de amoniaco o captura de CO2. Prescindir de la solución cuando al añadir 1 ó 2 ml a la muestra no se alcance un pH óptimo de 10±0.1
-
Preparación (NH4)2Fe(SO4)2 : Se disuelven 47.0g de sal, se deja enfriar y se enrasa a un litro con agua. Esta disolución debe factorizarse a diario con 10ml de K2Cr2O7 En presencia de H2SO4 (100ml) en presencia de ferroina como indicador.
-
Preparación K2Cr2O7: Se pesan exactamente 5.884g de dicromato secados durante una hora a 105ºC
-
Preparación de (KC8H5O4): Disolver en agua destilada 2.082 g de ftalato previamente desecado en la estufa una hora a 105ºC y entasar a 100ml
-
Preparación de ferroina: Se disuelven 0.7g de sal de Mohr en agua. Se añade 1.50g de 1,10-fenantrolina, se agita hasta que se disuelva y se enrasa a 100ml.
-
BIBLIOGRAFÍA
-
http://platea.pntic.mec.es/~iali/personal/agua/agua/propieda.htm
-
http://www.idaan.gob.pa/importancia.htm
-
http://www.ambientum.com/enciclopedia/enciclo_agua.htm
-
http://tar5.eup.us.es/master/analisis/protopdf/DURMAGNE.pdf
-
http://72.14.207.104/search?q=cache:UchjNlsffNEJ:tierra.rediris.es/hidrored/ponencias/marioa.html+conductividad+del+agua&hl=es&gl=es&ct=clnk&cd=4
-
http://www.ugr.es/~dpto_prev/Hig.Sanid.Ambient.4.98-105%20(2004).pdf
-
http://tar5.eup.us.es/master/analisis/protopdf/OXIDABIL.pdf
-
http://www1.ceit.es/Asignaturas/Ecologia/Hipertexto/11CAgu/100CoAcu.htm
-
http://www.fortunecity.es/expertos/profesor/171/agua.html
Ppm de O2 = 7.5ppm
| DETERMINACIÓN | resultado | valor optimo | valor minimo | valo MÁXIMO |
| Residuo seco (ppm) | <500 | 1500 | ||
| Dureza total (ºHT) | 30.2 | 15 | 50 | |
| Dureza cálcica (ppm Ca) | 81 | 100 | 200 | |
| Dureza magnesica (ppm Mg) | 24.3 | 30 | ND | |
| Fluoruros mg/L | 0.3 | 1.5 | ||
| Conductividad µS/cm a 20ºC | 596 | 2500 | ||
| Hierro Absorción atómica ppm | 0 | 2 | ||
| Hierro Uv-vis ppm | 0 | 2 | ||
| Na+ ppm | 21.5 | 200 | ||
| K+ ppm | 1.2 | 3.1 | ||
| NO2- ppm | 0 | 0.5 | ||
| NO3- ppm | 14.8 | 50 | ||
| Oxidabilidad ppm O2 | 7.5 | 5 | ||
| D.Q.O. | No realizada | |||
| Cloruros | No realizada | |||
| Sulfato | No realizada |
Tras las pruebas realizadas al agua, teniendo en cuanta los resultados obtenidos, se podría decir que es apta para el consumo, y dada la coincidencia en determinados análisis, del resultado con los valores óptimos, se podría considerar la muestra como un agua de buena calidad.
No obstante, si deducimos la calidad del agua en función de la dureza, la conclusión seria la de un agua de calidad media.
Se utiliza un matraz de 50ml para medir el volumen de muestra porque no hay pipetas de 50ml y es la forma mas precisa que tenemos de medir la muestra.
Descargar
| Enviado por: | Víctor Manuel García Julián |
| Idioma: | castellano |
| País: | España |
