Química
Ácido nítrico
República Bolivariana de Venezuela
Ministerio de Educación Cultura y Deporte
Instituto Universitario de Tecnología
“Rodolfo Loero Arismendi”
Caracas- Bello Monte.
HNO3
Ácido Nítrico
Marco Teórico
Se preparó por primera vez en 1648 a partir del Nitrato de Potasio por Glauber.
En 1783, Covendish logró la determinación de su composición.
Formula Mínima:

Formula de Lewis:
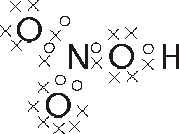
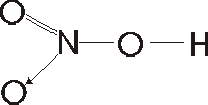
Formula Desarrollada:
Propiedades: El ácido Nítrico se halla en la atmósfera luego de las tormentas eléctricas. El HNO3 es un liquido incoloro que se descompone lentamente por la acción de la luz, adoptando una coloración amarilla por el NO2 que se produce en la reacción. En el aire húmedo despide humos blancos, su punto de fusión es de -43 ºC y su punto de ebullición es de 83 ºC pero a esa temperatura se acentúa su descomposición. Es soluble en agua en cualquier proporción y cantidad y su densidad es de 1,5 g/ml.
El Ácido Nítrico es uno de los más fuertes desde el punto de vista iónico. Pero lo que lo caracteriza químicamente es su energía de acción oxidante. La misma se manifiesta sobre casi todos los metales excepto por el Oro y el Platino, ciertas sales, sustancias orgánicas y en general sobre toda sustancia capaz de oxidarse. Así, una astilla de madera con un punto en ignición, al contacto con el Ácido Nítrico, sigue ardiendo con formación de CO2 y vapores rutilantes.
Este ácido es toxico, muy corrosivo, mancha la piel de amarillo y destruye las mucosas.
Su acción oxidante se intensifica cuando tiene disuelto Peróxido de Nitrógeno que actúa como catalizador; por eso el ácido más energético es el Ácido Nítrico Rojo Ofumante.
Propiedades químicas:
1) Ácido inestable.
Calentado se descompone:
4 HNO3 ------ 4NO2 ^ + 2H2O + O2 ^
En esta descomposición se verifica una oxidación-reducción.
4N + 4e -- 4N (reducción)
2O - 4e --- O2 (oxidación)
el nitrógeno pasa de pentavalente en el óxido nítrico a tetravalente en el óxido de nitrógeno reduciéndose, y el oxígeno pasa de combinado a libre oxidándose.
Esta descomposición la produce mas lentamente la luz por eso, el ácido nítrico debe guardarse en frascos esmerilados.
Los vapores rutilantes se disuelven en el ácido comunicándole al mismo coloración Rojo Pardo.
2) Es un ácido Monoprótico:
por eso solo forma sales neutras: Nitratos.
HNO3 -- [H ]+[NO3 ]
El radical nitrato posee una sola valencia, es decir, monovalente. Al formar sales, hay tantos radicales nitratos como valencias posea el metal.
NaNO3 Nitrato se Sodio
Ca (NO3)2 Nitrato de Calcio
Ba(NO3)2 Nitrato de Bario
Al(NO3)3 Nitrato de Aluminio
El ácido nítrico se disocia muy fácilmente, lo que permite que el mismo actúe sobre los elementos de forma eficaz. En otras palabras, es un ácido muy fuerte, vale decir, muy disociado.
3) Es un fuerte oxidante:
La acción oxidante del ácido nítrico se ejerce sobre los metales y los no metales.
El ácido nítrico concentrado forma los siguientes productos al actuar como oxidante:
2HNO3 2NO2 ^ + H2O + O ^
en cambio, el diluido se descompone así:
2HNO3 2NO^ + H2O + O ^
4) Acción del HNO3 sobre los NO metales:
Con el fósforo, el ácido nítrico actúa de esta forma:
10 HNO3 5 N2O5 + 5 H2O
5 N2O5 10 NO + 15 O
15 O + 6 P 3 P2O5
3P2O5 + 9 H2O 6 H3PO4
10 HNO3 + 6 P + 4 H2O 10 NO^ + 6 H3PO4
El proceso Redox es el siguiente:
10 N + 30 e 10 N (se reduce)
6 P - 30 e 6 P (se oxida)
el nitrógeno del ácido pasa a formar parte del óxido nítrico disminuyendo su valencia y reduciéndose.
El fósforo pasa de elemento libre a formar parte de un compuesto donde actúa con valencia +5.
Cede electrones, se oxida.
Con el azufre sucede lo siguiente:
2HNO3 H2O + N2O5
N2O5 2NO + 3 O
3 O + S SO3
SO3 + H2O H2SO4
2HNO3 + S 2NO^ = H2SO4
La ecuación Redox es:
S - 6e S (se oxida)
2N + 6e 2N (se reduce)
5) Reacción del HNO3 con los Metales:
Ataca a todos los metales excepto al Platino y al Oro.
La acción más energética la ejercita el ácido menos concentrado. Con el ácido diluido el cobre reacciona en frió así:
2 HNO3 H2O + N2O5
N2O5 2 NO + 3O
3O + 3 Cu 3 CuO
3 CuO + 6 HNO3 3 Cu(NO3)2 + 3 H2O
8 HNO3 + 3Cu 4 H2O + 3 Cu(NO3)2 + 2 NO ^
El NO incoloro se une en el aire con el O2 y da vapores rutilantes de NO2
La ecuación de oxidación-reducción es:
2N + 6e 2N (se reduce)
3 Cu - 6e (se oxida)
si el ácido nítrico es concentrado, la reacción es esta:
2 HNO3 H2O + N2O5
N2O5 2 NO2 + O
O + Cu CuO
CuO + 2 HNO3 Cu(NO3)2 + H2O
4 HNO3 + Cu 2 H2O + 2 NO2 + Cu(NO3)2
Reacción del HNO3 sobre la materia orgánica:
Ataca la materia orgánica, es tóxico y muy corrosivo, ataca las mucosas, en contacto con la piel la colorea de amarillo, esta es una reacción debida a las proteínas de la piel y se llama “Reacción Xantoprotéica”.
Agua Regia:
Una mezcla formada por tres volúmenes de HCl y por una de HNO3 se la llama “Agua Regia” por atacar al Oro y al Platino:
2HNO3 H2O + N2O5
N2O5 2 NO + 3O
3O + 6 HCl 3 H2O + 6 HCl
2 HNO3 + 6 HCl 4 H2O + 2 NO^ + 6 Cl
Este cloro atómico reacciona con el Oro y el Platino.
Aplicaciones del HNO3:
El HNO3 es uno de los ácidos mas importantes desde el punto de vista de vida industrial, pues se le consume en grandes cantidades en la industria de los abonos, colorantes, explosivos, fabricación del ácido sulfúrico, medicamentos y grabado de metales.
Los métodos de fijación de nitrógeno atmosférico (procedimiento de Birbeland-Eyde) y los estudiados para el amoníaco (Haber), complementados en la síntesis de Osdwald, tienen enorme importancia industrial y en particular para la agricultura pues las reservas naturales de abonos naturales como el salitre son insuficientes para satisfacer las necesidades de los cultivos, por lo que el aprovechamiento del nitrógeno atmosférico resolvió un problema de capital interés al suministrar nitratos minerales en grandes cantidades y a bajo costo.
Los explosivos modernos que han reemplazado a la antigua pólvora negra, son derivados nitratos obtenidos por la acción del ácido nítrico sobre alguna sustancia orgánica: con el algodón forma Algodón Pólvora o nitrocelulosa y se usa para el colodión y celuloide.
Con el Tolueno da lugar a la formación del TRINITROTOLUENO (T.N.T.) o Trotyl.
Es empleado para preparar Nitrobenceno, base de la anilina.
Con la glicerina constituye la Nitroglicerina, que mezclada con tierra porosa constituye la Dinamita.
Se prepara con el ácido piérico y Nitrato de Plata usado en la fotografía.
Por su acción oxidante, se emplea en muchos procesos y por la acción nitrante en la industria de los colorantes.
Forma con el ácido clorhídrico y con el ácido sulfúrico la terna de ácidos de mayor aplicación industrial.
Método Industrial: “La Síntesis de Oswald”
Se hacen pasar vapores de amoníaco y aire previamente calentados por una malla de platino a 1000ºC.
Se produce la Siguiente reacción:
4NH3 + 5O2 4NO ^ + 6 H2O
este gas pasa a unas torres metálicas de absorción donde se produce esta otra reacción:
2 NO + O2 2 NO2 ^
este dióxido de nitrógeno con agua forma:
3 NO2 + H2O 2 HNO3 +NO ^
El óxido nítrico vuelve a dar la reacción:
2 NO + O2 2 NO2 ^
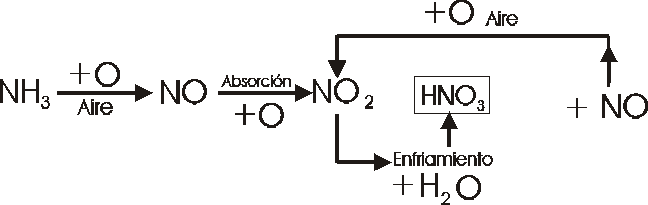
Marchas Analíticas
Obtención:
En un balón de destilación o retorta, colocar 5 gr. De nitrato sódico
Adiciona 5 ml de ácido sulfúrico concentrado.
Colocar el equipo de destilación, asegurando que el sistema este abierto.
Recolecte el ácido en una fiola de 50ml que este sumergida en agua helada
Continué el calentamiento hasta que ya no se observe ebullición.
Esperar a que el sistema se enfrié para comenzar el desmontaje.
Propiedades e Identificación:
a)En un tubo de ensayo colocar un trocito de alambre de cobre
Añadir tres o cuatro gotas del ácido obtenido en la marcha 1.
Esperar tres minutos y añadir dos mililitros de agua destilada
Observar lo sucedido y dar comentarios.
b)En un tubo de ensayo colocar aproximadamente 0.1 grs. de oxido cuprico negro.
Añadir 5 gotas de agua destilada y 5 gotas del ácido obtenido en la marcha 1
Observar lo ocurrido y comparar con el ensayo anterior.
c)En un tubo de ensayo colocar aproximadamente 0.1 gr. de sulfito de sodio.
Añadir 3 o 4 gotas del ácido obtenido en la marcha 1.
Anotar sus observaciones y explicar lo sucedido.
d)Calcule aproximadamente la densidad del producto obtenido en la marcha 1.
a)Pese un cilindro graduado de 10ml.
b)Coloque el producto obtenido en la marcha 1
c)Pese el cilindro graduado con el producto
d)Reste el peso del cilindro, menos el peso del cilindro con producto
e)Aplique la formula d=m/v.
Resultado y Observaciones
Obtención: Preparación del HNO3
Tratando al Nitrato de Sodio con ácido sulfúrico concentrado. Se aplica una de las reglas de Bertholet, pues el ácido sulfúrico es mas fijo que el ácido nítrico.
NaNO3 + H2SO4 NaHSO4 + HNO3
Si se eleva la temperatura:
NaHSO4 + NaNO3 Na2SO4 + HNO3
Sumando ambas reacciones:
2 NaNO3 + H2SO4 Na2SO4 + 2 HNO3
Experiencia: obtención del ácido nítrico en el laboratorio.
Se colocan en una retorta 4.9717 gr. de Nitrato de Sodio seco y 5 ml. de ácido sulfúrico concentrado.
El pico de la retorta debe penetrar profundamente en el cuello de la fiola. La fiola se coloco dentro de una cápsula de porcelana grande y se lleno con agua fría para que refrigere el condensado obtenido.
Al comienzo se producen vapores rutilantes debido a que se descompone el anhídrido nítrico producto de la deshidratación que el ácido sulfúrico ocasiona en el nítrico.
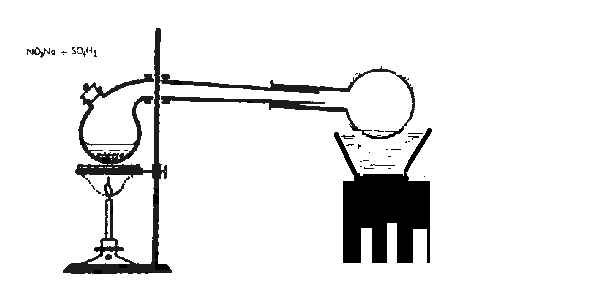
Esta atmósfera roja desaparece y cuando comienza a aparecer de nuevo por descomposición del HNO3 formado por acción de la temperatura, se interrumpe la operación.
ParteII
Propiedades e Identificación:
Experimento A
La acción oxidante del ácido nítrico se ejerce sobre los metales, el ácido nítrico concentrado forma los siguientes productos al actuar como oxidante (por ejemplo frente a un metal):![]()
En cambio diluido se comporta así:![]()
REACCIÓN CON LOS METALES: Ataca a todos los metales excepto al platino y al oro. La acción más energética la ejercita al ácido menos concentrado. Con el ácido diluido el cobre reacciona en frío. El NO incoloro se une en el aire con el O2 y da vapores rutilantes de NO2.
En principio de la prueba se observa que la solución se torna verde claro y al tacto se observa desprendimiento de calor y gases de color café, dióxido de nitrógeno. Al adicionar agua la muestra cambia a color azul, lo que indica la presencia de cobre. Esta coloración se da debido al rompimiento de los enlaces de hidrógeno y la energía desprendida es adsorbida por el cobre presente. Se corrobora así la reacción indicada en las ecuaciones anteriores.
Experimento B
CuO + H2O Cu(OH)2
Cu(OH)2 + 2HNO3 Cu(NO3)2 +2 H2O
Al adicionar agua al oxido cuprico observamos una mezcla azulada obteniendo la formación de oxido cuprico, agregamos ácido nítrico y se observa como la solución se torna color verde azulado lo que indica la presencia de una sal de cobre hidratada.
Experimento C
NaNO3 + 2HNO3 2NaNO3 + H2O + SO3
Al tubo de ensayo que contenía sulfito de sodio se le añadió ácido nítrico, de inmediato se observa la reacción exotérmica que libera un gas de color amarillo oscuro (SO2), se forma un precipitado que es el nitrato de sodio y un sobrenadante que es el agua. Así, se verifica la ecuación anterior.
Cálculos y Resultados.
NaNO3 + H2SO4 Na2SO4 + 2 HNO3
gr. 4.8722gr. 9.2gr. 7.18gr
Mw 84.99 98.08 63gr/mol
Mol 0.114mol "0.114mol 0.114mol
gr. H2SO4 = 5ml x 1.84gr. = 9.2gr.
ml
gr.NaNO3= 4.9717 x 98 gr. = 4.8722 gr.
100
ó se puede aplicar el siguiente calculo.
4.9717gr.NaNO3 x 98gr x . mol x 1mol HNO3 x 63gr. 7.22gr HNO3
100gr 84.99gr 2mol NaNO3 mol
R= Re/Rt R= 5.1678gr. HNO3 x100= 71.6%
7.22gr. HNO3
Calculo de densidad.
Peso del cilindro vacío 14.5455gr.
Peso del cilindro graduado lleno 19.7133gr
Peso del ácido 19.7133gr-14.5455gr= 5.1678gr
Volumen de ácido en el cilindro = 3.5ml.
Densidad = 5.1678gr. = 1.48gr./mL.
3.5mL.
Materiales y Equipos Usado
Balanza Mettler modelo AJ180 apreciación 0.0001gr.
Retorta para destilación.
Enlermeyer de 125ml.
Cápsula de porcelana de 250mL.
Soporte universal.
Pinza.
Mechero.
Aro metálico
Tela de amianto
Soporte de cerámica.
Tobos de ensayo.
Reactivos y Soluciones
Sulfato de sodio.
Ácido sulfúrico.
Alambre de cobre
Oxido cuprico
Sulfito de sódio
3
Descargar
| Enviado por: | Hugo Ojeda |
| Idioma: | castellano |
| País: | Venezuela |
